一般(PNAS, Nat. Commun.)、化学(JACS, ACIE)、生化学(JBC)、物理化学(JPC, Biochemistry)、生物物理(Biophys. J.)の雑誌などに載せて頂いています【業績リスト】。
以下からも検索できます。 Pubmed Google Scholar Research Gate
■2023年~
■2022年
■2021年
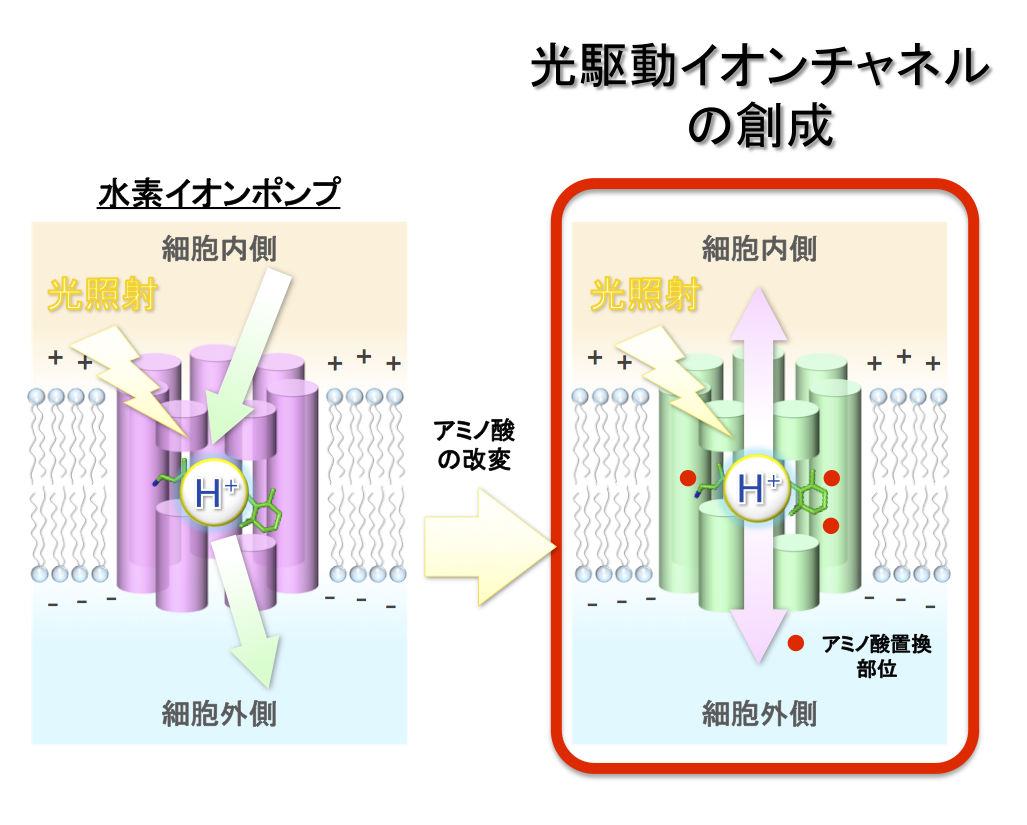
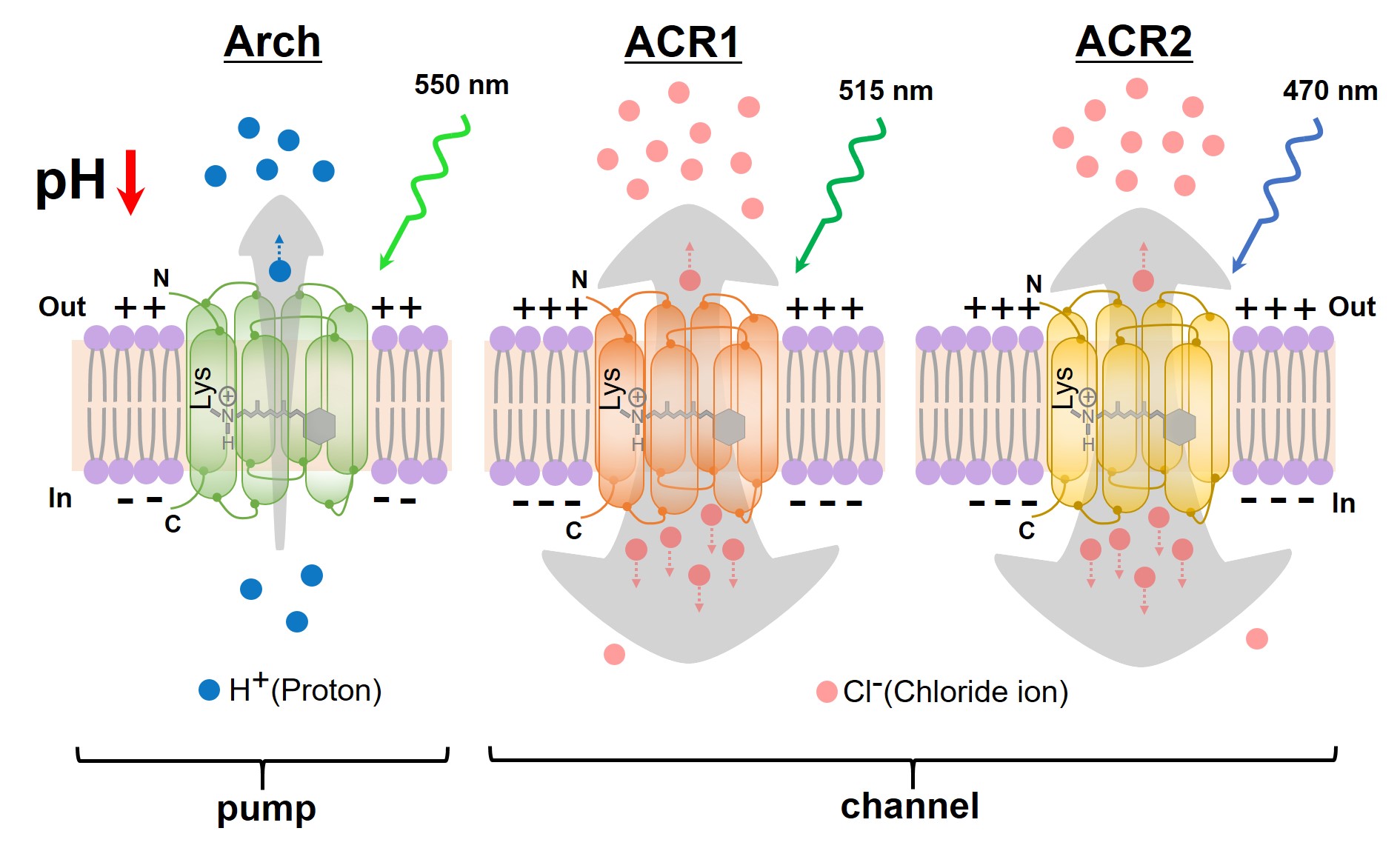
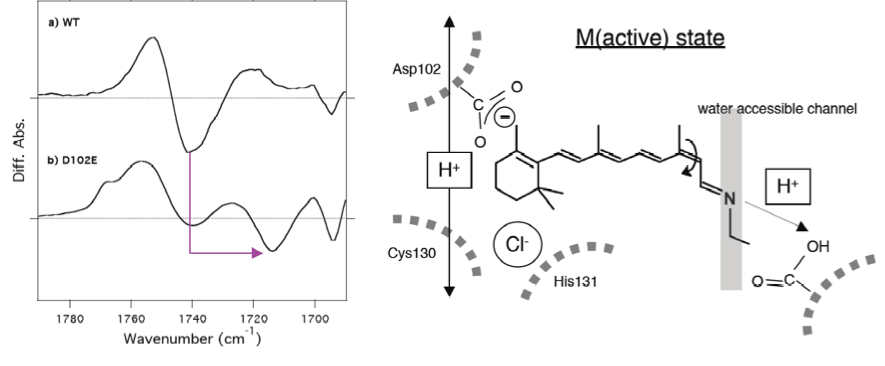
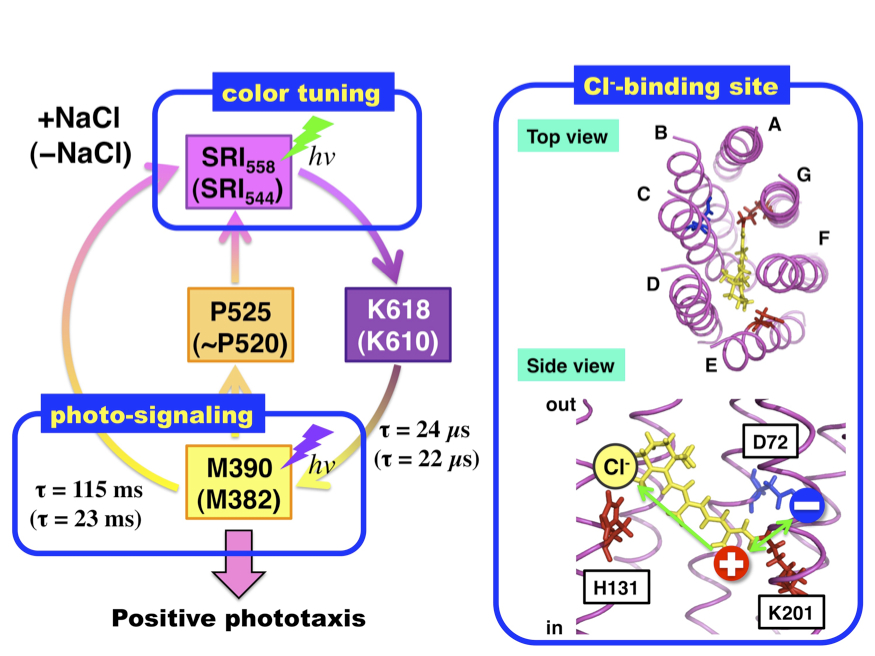
◎Tsujimura M,# Kojima K,# Kawanishi S, *Sudo Y. & *Ishikita H. (#These authorscontributed equally to this work) “Proton transfer pathway in anion channelrhodopsin-1” (2021) eLife 10, e72264. <2021/12/21>【link】(東京大学・石北博士、辻村さんとの共同研究,小島さん(助教)、川西さん(M1)の成果)
◎ Tsuneishi T,# Takahashi M,# Tsujimura M,# Kojima K, Ishikita H, Takauchi Y, & *Sudo Y. “Exploring the retinal binding cavity of archaerhodopsin-3 by replacing the retinal chromophore with a dimethyl phenylated derivative” (2021) Front. Mol. Biosci. 8, 794948. <2021/12/20>【link】(*恒石くん(M1)の成果、東京大学・石北博士、岡山大学・竹内博士らとの共同研究)
◎ Kojima K, Matsutani Y, Yanagawa M, Imamoto Y, Yamano Y, Wada A, Shichida Y & *Yamashita T. “Evolutionary adaptation of visual pigments in geckos for their photic environment” (2021) Sci. Adv. 7, eabj1316. <2021/10/01>【link】(*小島さん(助教)の成果、京都大学・山下高廣博士との共同研究)
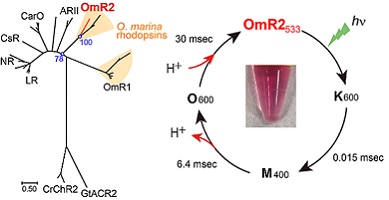
◎ Kikuchi M,# Kojima K,# Nakao S, Yoshizawa S, Kawanishi S, ShibukawaA, Kikukawa T, & *Sudo Y. (#These authors contributed equally to this work)“Functional expression of the eukaryotic proton pump rhodopsin OmR2 in Escherichia coli and its photochemical characterization” (2021) Sci. Rep. 20, 14765. <2021/07/07>【link】(*菊池さん(薬卒)、中尾君(B6)、川西さん(M1)らの成果、*東京大学・吉澤晋博士、北海道大学・菊川峰志博士らとの共同研究)
◎*Kawamura I, Seki H, Tajima S, Makino Y, Shigeta A, Okitsu T, Wada A, Naito A, & Sudo Y. Structure of a retinal chromophore of dark-adapted middle rhodopsin as studied by solid-state nuclear magnetic resonance spectroscopy” (2021) Biophys. Physicobiol. 18, 177-185. <2021/07/12>【link】 (*横国大・川村出博士らとの共同研究)
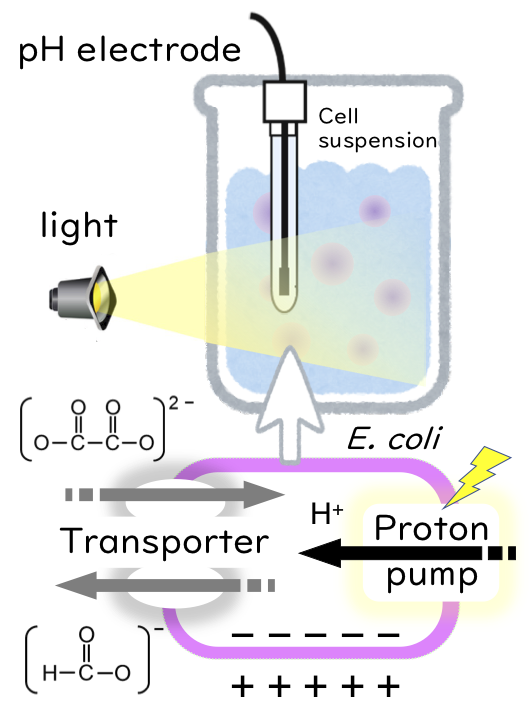
◎ Hayashi M, Kojima K, *Sudo Y, & *Yamashita A. “An optogenetic assay method for electrogenic transporters using Escherichia coli co-expressing light-driven proton pump” (2021) Protein. Sci. 30, 2161-2169. <2021/07/03>【link】 (*岡山大学・山下敦子博士らとの共同研究)
◎ 須藤雄気, 小島慧一“マルチタレント光受容タンパク質「ロドプシン」” (2021) 現代化学. 5, 50-53. <2021/02/17>【link】
◎ Akiyama T, *Kunishima M, Nemoto S, Kazama K, Hirose M, Sudo Y, Matsuura Y, Naitow H, & *Murata T. “Further thermo-stabilization of thermophilic rhodopsin from Thermus thermophilus JL-18 through engineering in extramembrane regions” (2020) Proteins: Struct. Funct. Bioinf. 89, 301-310. <2020/03/01>【link】 (*(株)リガク・国島直樹博士、千葉大学・村田武士博士らとの共同研究)
◎ Tsujimura M, Noji T, Saito K, Kojima K, Sudo Y, & *Ishikita H. “Mechanism of absorption wavelength shifts in anion channelrhodopsin-1 mutants” (2021) Biochim. Biophys. Acta (Bioenergetics). 1862, 148349 <2021/02/10>【link】(*東京大学・石北央博士らとの共同研究)
◎ 須藤雄気, 小島慧一 “光合成生物の形質転換体およびその用途” (2021) 特願2021-89800.<2021/05/28>
◎ 渋川敦史、須藤雄気, ムサクジャング “光変調装置及び集光装置” (2021) 特願2021-153788.<2021/09/22>
◎ 小島慧一 “光受容タンパク質・ロドプシンの生物物理化学研究” (2021) 薬学雑誌. 141, 1155-1160.<2021/10/01>【link】
◎ Nakao S, Kojima K, & *Sudo Y. “Microbial rhodopsins as multi-functional photoreactivemembrane proteins for optogenetics” (2021) Biol. Pharm. Bull. 44, 1357-1363. <2021/07/27>【link】 (*中尾君(B6)らの成果)*Featured Articleに選ばれました"
■2020年
◎ Kojima K,# Yoshizawa S,# Hasegawa M, Nakama M, Kurihara M, Kikukawa T, & *Sudo Y. (#Equal contribution) “Lokiarchaeota archaeon Schizorhodopsin-2 (LaSzR2) is an inward proton pump displaying a characteristic feature of acid-induced spectral blue-shift” (2020) Sci. Rep. 10, 20857. <2020/10/29> (*小島さん(助教), 仲間君(M2), 栗原(眞)さん(D3)の成果, *東京大学・吉澤晋博士、北海道大学・菊川峰志博士との共同研究)
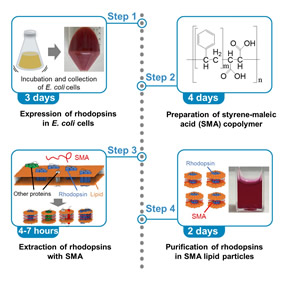
◎ Ueta T, Kojima K, Hino T, Shibata M, Nagano S, & *Sudo Y. “Applicability of styrene-maleic acid (SMA) copolymer for two microbial rhodopsins, RxR and HsSRI” (2020) Biophys. J. 119, 1760-1770. <2020/09/21>【link】【link】 (*上田くん(M2)の成果, *鳥取大学・日野智也博士、永野真吾博士、金沢大学・柴田幹大博士らとの共同研究)
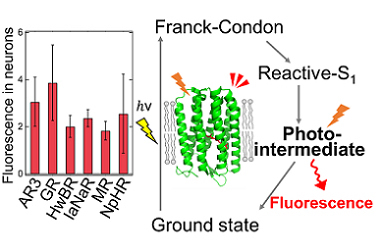
◎ Kojima K,# Kurihara R,# Sakamoto M,# Takanashi T, Kuramochi H, Zhang X.M, Bito H, Tahara T, & *Sudo Y. (#Equal contribution) “Comparative studies of the fluorescence properties of microbial rhodopsins: Spontaneous emission versus photo-intermediate fluorescence” (2020) J. Phys. Chem. B. 124, 7361-7367 <2020/07/30>【link】 (*小島さん(助教), 栗原(里)さん(卒)の成果, *東京大学・坂本雅行博士(現・京都大学)、尾藤晴彦博士、理化学研究所・田原太平博士らとの共同研究)
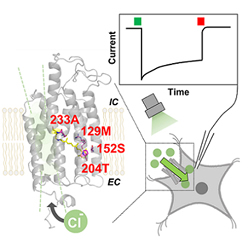
◎ Kojima K,# Miyoshi N,# Shibukawa A, Chowdhury S, Tsujimura M, Noji T, Ishikita H, Yamanaka A, & *Sudo Y. (#Equal contribution) “Green-sensitive, long-Lived, step-Functional anion channelrhodopsin-2 variant as a high-potential neural silencing tool” (2020) J. Phys. Chem. Lett. 11, 6214-6218. <2020/07/13>【link】(*小島さん(助教), 三好さん(卒)の成果, *東京大学・石北央博士、名古屋大学・山中章弘博士らとの共同研究) *プレスリリース* *日経新聞(電子版)の記事* *日刊工業新聞*
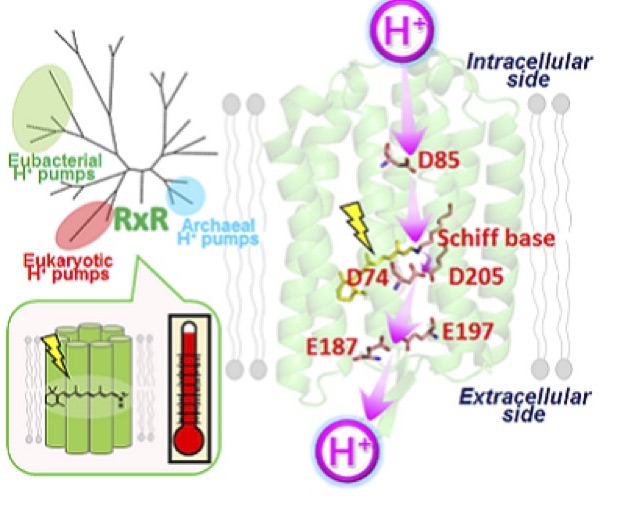
◎ Kojima K, Ueta T, Noji T, Saito K, Kanehara K, Yoshizawa S, Ishikita H, & *SudoY. “Vectorial proton transport mechanism of RxR, a phylogenetically distinct and thermally stable microbial rhodopsin” (2020) Sci. Rep. 10, 282. <2020/01/14>【link】(*小島さん(助教), 上田くん(M1)の成果, *東京大学・石北央博士らとの共同研究)
◎ *Nakajima Y, Kojima K, Kashiyama Y, Doi S, Nakai R, Sudo Y, Kogure K, & *Yoshizawa S. “Bacterium lacking a known gene for retinal biosynthesis possesses functional rhodopsins” (2020) Microbes Environ. 35, ME20085 【link】(*東京大学・中島悠博士(現・産総研)、吉澤晋博士らとの共同研究、*一部土井さん(修卒)の成果)
◎ Hasegawa M, Hosaka T, Kojima K, Nishimura Y, Nakajima Y, Kimura-Someya T, Shirouzu M, Sudo Y, & *Yoshizawa S. “A unique clade of light-driven proton-pumping rhodopsins evolved in the cyanobacterial lineage” (2020) Sci. Rep. 10, 16752.<2020/09/15>【link】(*東京大学・長谷川さん、吉澤晋博士らとの共同研究)
◎ Ohn HM, Mizuno T, Sudo Y, & *Miyoshi SI. “Interaction of Escherichia Coli and Its Culture Supernatant With Vibrio Vulnificus During Biofilm Formation” (2020) Microbiol. Immunol. 64, 593-601. <2020/06/30>【link】(*本学薬学部・三好伸一博士らとの共同研究)
◎ Yasuda S, Akiyama T, Nemoto S, Hayashi T, Ueta T, Kojima K, Tsukamoto T, Nagatoishi S, Tsumoto K, Sudo Y, Kinoshita M, & *Murata T. “Methodology for Further Thermostabilization of an Intrinsically Thermostable Membrane Protein Using Amino Acid Mutations With Its Original Function Being Retained” (2020) J. Chem. Inf. Model. 60, 1709-1716. <2020/03/10>【link】 (*上田君(M2)の成果, *千葉大学・村田武士博士、京都大学・木下正弘博士らとの共同研究)
◎ Hayashi T, Yasuda S, Suzuki K, Akiyama T, Kanehara K, Kojima K, Tanabe M, Kato R, Senda T, Sudo Y, *Murata T, & *Kinoshita M. “How does a microbial rhodopsin RxR Realize Its Exceptionally High Thermostability with the Proton-Pumping Function Being Retained?”
(2020) J. Phys. Chem. B 124, 990-1000. <2020/01/19>【link】(*金原さん(卒)の成果, *千葉大学・村田武士博士、京都大学・木下正弘博士らとの共同研究)
◎ 須藤 雄気,& 小島 慧一 “微生物ロドプシンの多様性と可能性” (2020) 60, 209-214 [解説] 【link】 *表紙図に採用されました*
◎ Kojima K, Shibukawa A, & *SudoY. “The unlimited potential of microbial rhodopsins as optical tools” (2020) Biochemistry 59, 218-229 [Perspective] 【link】 (*小島さん(助教), 渋川さん(特任助教)の成果)
◎ 須藤雄気, 小島慧一、中尾新 “光により細胞死を制御する方法” (2020) 特願2020-196718.<2020/11/27>【link】
◎ 坂本雅行, チョウシャオミン、尾藤晴彦, 須藤雄気, 小島慧一 “膜電位センサー” (2020) 特願2020-70136.<2020/04/09>【link】(*東京大学・坂本博士(現京都大学)、尾藤博士らとの共同研究)
■2019年
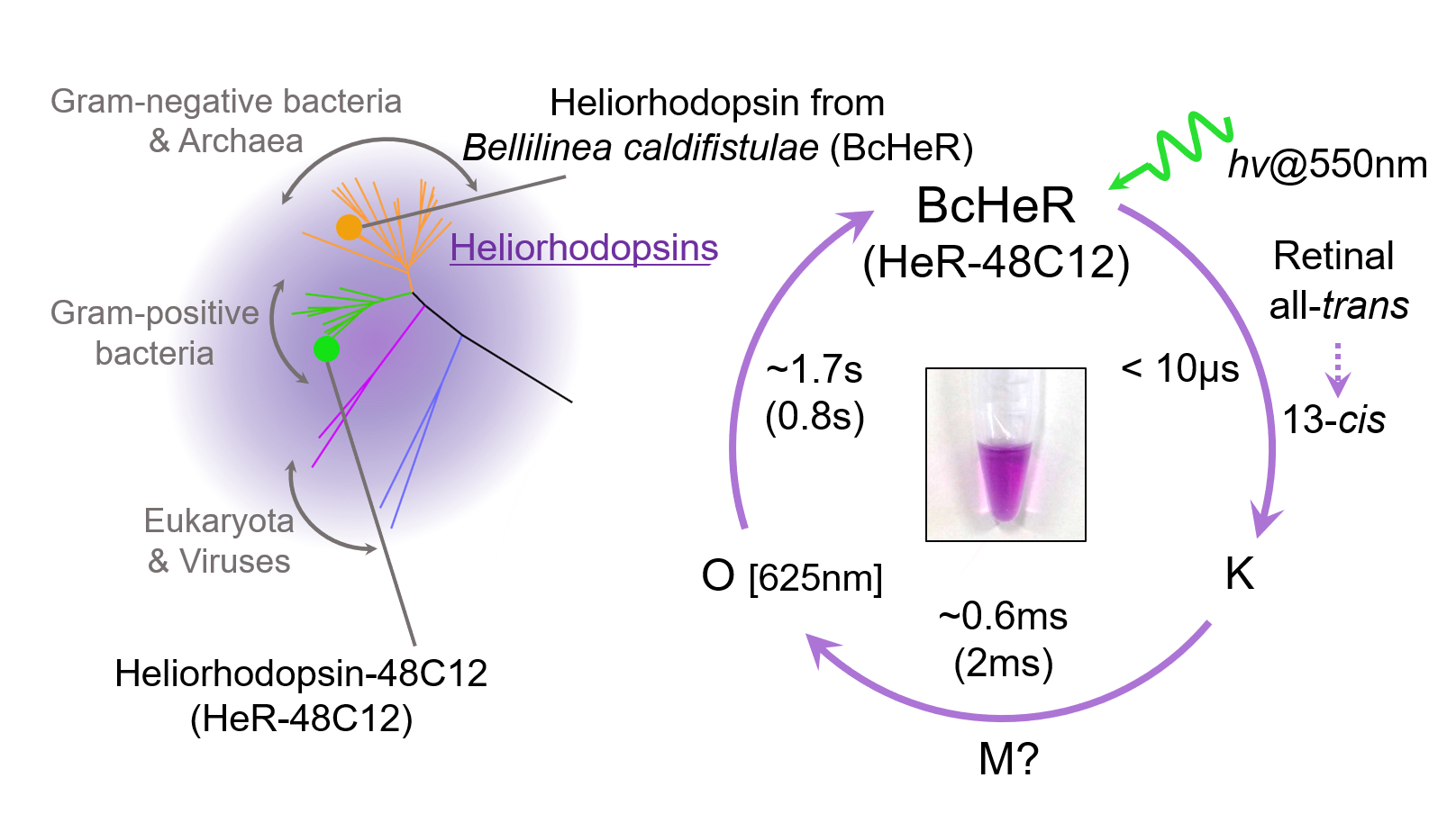
◎ Shibukawa A, Kojima K, Nakajima Y, Nishimura Y, Yoshizawa S, & *Sudo Y. "Photochemical characterization of a new heliorhodopsin from the gram-negativeeubacterium Bellilinea caldifistulae (BcHeR) and comparison with heliorhodopsin-48C12" (2019) Biochemistry 58, 2934.2943.【link】(*渋川さん(特任助教)、小島さん(助教)の成果, *東京大学・吉澤晋博士らとの共同研究)
◎ Yamanashi T, Maki M, Kojima K, Shibukawa A, Tsukamoto T, Chowdhury S, Yamanaka A, Takagi S, & *Sudo Y. "Quantitation of the neural silencing activity of anion channelrhodopsins in Caenorhabditis elegans and their applicability for long-term illumination" (2019) Sci. Rep. 9, 7863.【link】(*山梨くん(M2),真木さん(卒業生)らの成果, *名古屋大学・山中章弘博士,高木新博士らとの共同研究)
◎ Needham DM, Yoshizawa S, Hosaka T, Poirier C, Choi CJ, Hehenberger E, Irwin NAT, Wilken S, Yung CM, Bachy C, Kurihara R, Nakajima Y, Kojima K, Kimura-Someya T,Leonard G, Malmstrom RR, Mende DR, Olson DK, Sudo Y, Sudek S, Richards TA, DeLong EF, Keeling PJ, Santoro AE, Shirouzu M, Iwasaki W, Worden AZ. "A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators" (2019) Proc. Natl. Acad. Sci. USA 116, 20574-20583【link】(*栗原さん(M2),小島さん(助教)らの成果, *モントレーベイ水族館・Worden博士, 東京大学・吉澤晋博士らとの共同研究)
◎ Sano D, Ide I, Akiyama T, Tanaka Y, Sudo Y, Murata T, & *Ishii H. "Application of high-sensitivity UV photoemission spectroscopy to examine the electronic structure of thermophilic rhodopsin" (2019) Mol. Crys. Liq. Crys. 687, 34-39.【link】(*千葉大学・石井久夫博士らとの共同研究)
◎ Chowdhury S, Matsubara T, Miyazaki T, Ono D, Fukatsu N, Abe M, Sakimura K, Sudo Y, & *Yamanaka A. "GABA neurons in the ventral tegmental area regulate non-rapid eye movement sleep in mice" (2019) eLife 8, e44928.【link】(*名古屋大学・山中章弘博士らとの共同研究)
◎ Misra R, Eliash T, Sudo Y, & *Sheves M. "Retinal-Salinixanthin Interactions in a Thermophilic Rhodopsin" (2019) J. Phys. Chem. B 123, 10-20.【link】(*Weizmann Institute of Science(イスラエル), Sheves博士らとの共同研究)
■2018年
◎Kojima K#, Watanabe HC#, Doi S, Miyoshi N, Kato M, *Ishikita H, & *Sudo Y. (#These authors contributed equally to this work) "Miutational analysis of the conserved carboxylates of anion channelrhodopsin-2 (ACR2) expressed in Escherichia coli and their roles in anion transport" (2018) Biophys. Physicobiol. 15, 179-188 【link】
アニオンチャネルロドプシンにおける酸性アミノ酸の役割:(*小島さん(助教),土井さん(卒業生),三好さん(M1)の成果)(*東京大学・渡邊宙志 博士、石北央 博士らとの共同研究)
◎ Takayama R, Kaneko A, Okitsu T, Tsunoda SP, Shimono K, Mizuno M, Kojima K, Tsukamoto T, Kandori H, Mizutani Y, Wada A, & *SudoY. "Production of a light-gated proton channel by replacing the retinal chromophore with its synthetic vinylene derivative" (2018) J. Phys. Chem. Lett. 9, 2857-2862.【link】
合成レチナールアナログによる光開閉型プロトンチャネルの創成:(高山理穂さん(卒業生)、金子明正くん(B6)の成果)
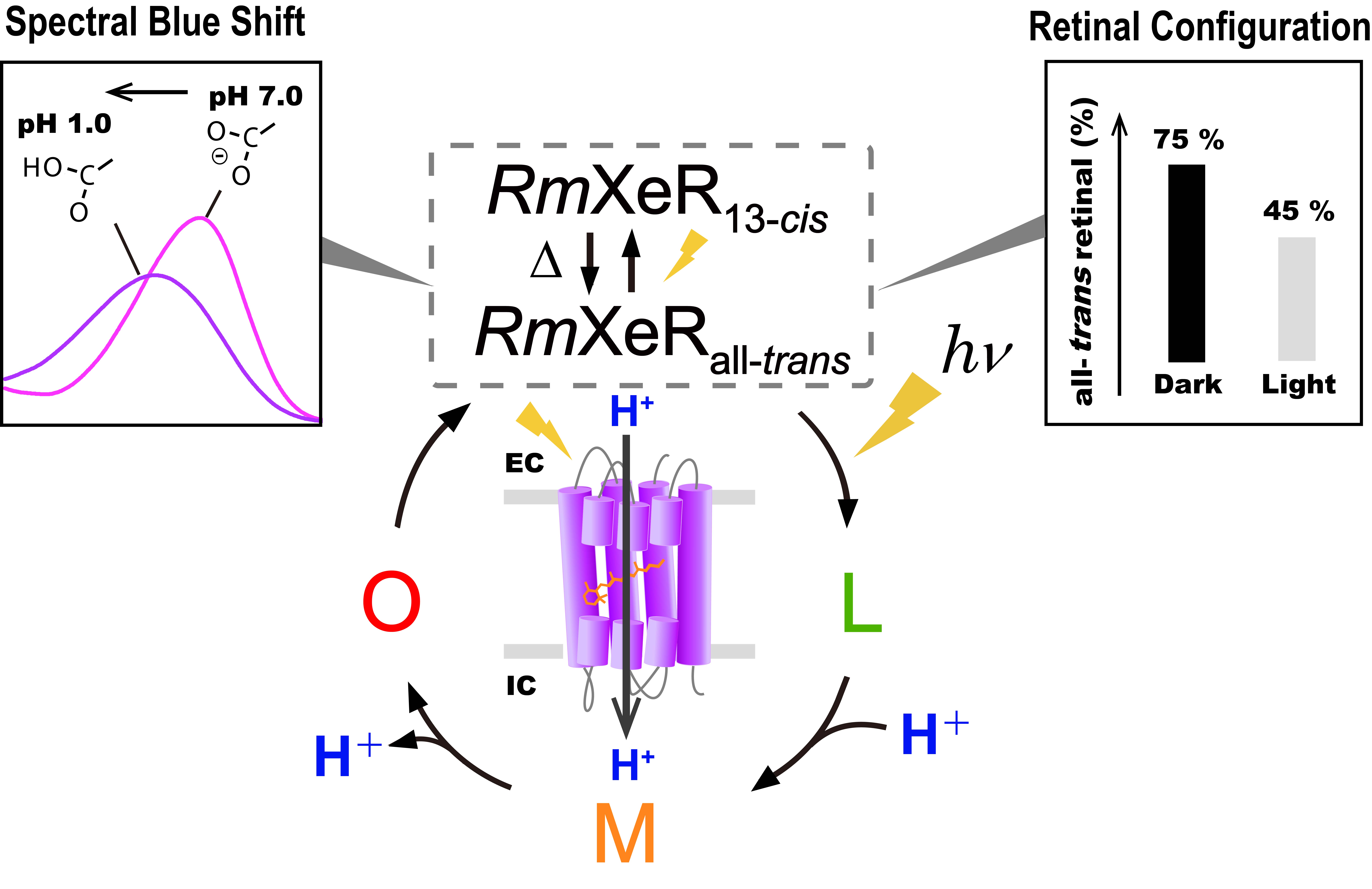
◎ Inoue S, Yoshizawa S, Nakajima Y, Kojima K, Tsukamoto T, Kikukawa T, & *Sudo Y. "Spectroscopic characteristics of Rubricoccus marinus xenorhodopsin (RmXeR) and a putative model for its inward H+ transport mechanism" (2018) Phys. Chem. Chem. Phys. 20, 3172-3183.
光駆動内向き(細胞内)へのH+ポンプの発見と分光学的解析:(M1・井上紗希さんの成果)
◎ *Nakajima Y, Tsukamoto T, Kumagai Y, Ogura Y, Hayashi T, Song J, Kikukawa T, Demura M, Kogure K, Sudo Y, & *Yoshizawa S. "Presence of a haloarchaeal halorhodopsin-like Cl- pump in marine bacteria" (2018) Microbes Environ. 33, 89-97 【link】(*東京大学・吉澤晋 博士らとの共同研究)
◎ Makino Y, *Kawamura I, Okitsu T, Wada A, Kamo N, Sudo Y, *Ueda K, & *Naito A.
"Retinal configurations of ppR intermediates revealed by photo-irradiation solid-state NMR and DFT" (2018) Biophys. J. 115, 72-83. 【link】(*横浜国立大学・内藤晶 博士、川村出 博士らとの共同研究)

◎ Shionoya T, Mizuno M, Tsukamoto T, Ikeda K, Seki H, Kojima K, Shibata M, Kawamura I, Sudo Y, & *Mizutani Y. "High thermal stability of oligomeric assemblies of thermophilic rhodopsin in a lipid environment" (2018) J. Phys. Chem. B 122, 6945-6953.【link】(*大阪大学・水谷泰久 博士、金沢大学・柴田幹大 博士らとの共同研究)
■2017年
◎ Honda N, Tsukamoto T, & *Sudo Y. "Comparative evaluation of the stability of seven-transmembrane microbial rhodopsins to various physicochemical stimuli" (2017) Chem. Phys. Lett. 682, 6-14.
様々なロドプシンの様々な物理化学的刺激に対する安定性比較:(B6・本田尚也くんの成果)
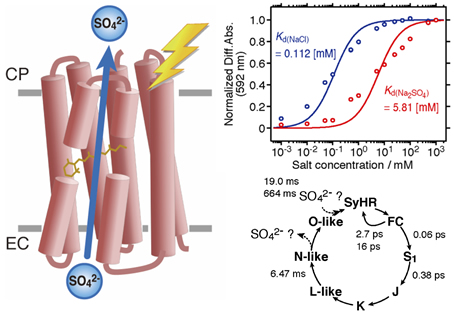
◎ Niho A, Yoshizawa S, Tsukamoto T, Kurihara M, Tahara S, Nakajima Y, Mizuno M, Kuramochi H, Tahara T, Mizutani Y, & *Sudo Y. "Demonstration of a light-driven SO42- transporter and its spectroscopic characteristics" (2017) J. Am. Chem. Soc. 139, 4376-4389.
二価イオンを運ぶタンパク質の発見と分光学的解析:(B5・仁保亜紀子さんの成果)
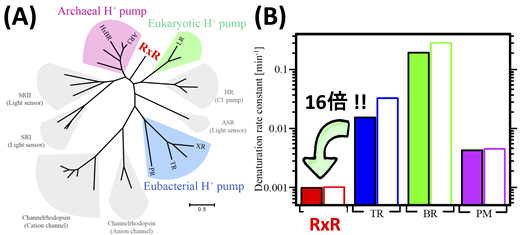
◎ Kanehara K, Yoshizawa S, Tsukamoto T, *Sudo Y. "A phylogenetically distinctive and extremely heat stable light-driven proton pump from the eubacterium Rubrobacter xylanophilus DSM 9941T" (2017) Sci. Rep. 7, 44427.
分子進化的にユニークで極めて熱に安定なロドプシン:(B4金原加苗さんの成果)
◎ *Tsukamoto T, Yoshizawa S, Kikukawa T, Demura M, & *Sudo Y. "Implications for the light-driven chloride ion transport mechanism of Nonlabens marinus rhodopsin 3 by its photochemical characteristics" (2017) J. Phys. Chem. B 121, 2027-2038.
真正細菌型アニオンポンプのイオン輸送機構の解析:(助教・塚本卓さんの成果)
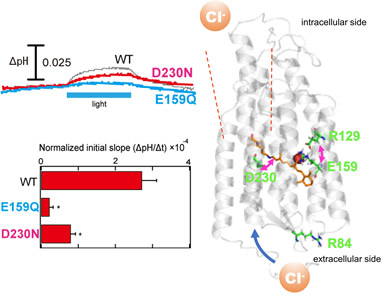
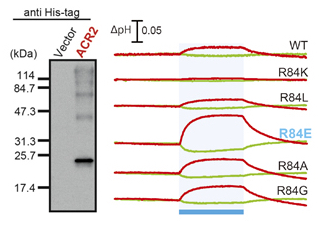
◎ Doi S, Tsukamoto T, Yoshizawa S, *Sudo Y. "An inhibitory role of Arg-84 in anion channelrhodopsin-2 expressed in Escherichia coli" (2017) Sci. Rep. 7, 41879.
アニオンチャネルロドプシンにおけるR84の役割:イオンチャネル型ロドプシンは、生命機能の光操作技術(光遺伝学)に用いられます。本研究では、1) アニオンチャネルロドプシン2の大腸菌発現系の構築に成功し、2) 網羅的変異実験から、保存性アミノ酸であるR84の機能への役割(阻害効果)を明らかにしました。つまり、R84への変異でイオン透過活性が大きく上昇することがわかり、強力な光遺伝学ツールとしての応用が期待できます。(M1・土井聡子さんの2報目の筆頭著者論文)
◎ Nishimura T, Tamura F, Kobayashi S, Tanimoto Y, Hayashi F, Sudo Y, Iwasaki Y, & *Morigaki K. "Hybrid model membrane combining micropatterned lipid bilayer and hydrophilic polymer brush" (2017) Langmuir33, 5757-5759.【link】(*神戸大学・森垣憲一 准教授らとの共同研究)
◎ *Adachi S, Watanabe Y, Sudo Y. & Suzuki T. "Few-cycle Pulse Generation from Noncollinear Optical Parametric Amplifier with Static Dispersion Compensation" (2017) Chem. Phys. Lett. 683, 7-11.【link】(*京都大学・足立俊輔准教授らとの共同研究)
■2016年
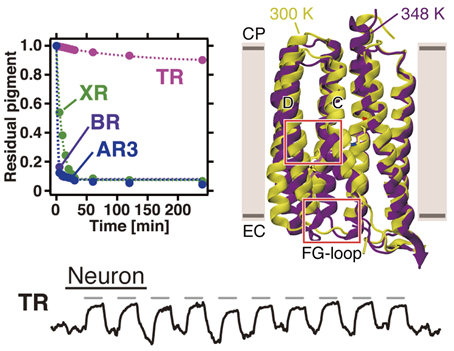
◎ Tsukamoto T,† Mizutani K,† Hasegawa T, Takahashi M, Honda N, Hashimoto N, Shimono K, Yamashita Y, Yamamoto M, Miyauchi S, Takagi S, Hayashi S, *Murata T, *Sudo Y. (†equal contribution) "X-ray crystallographic structure of thermophilic rhodopsin: implications for high thermal stability and optogenetic function" (2016) J. Biol. Chem. 291, 12223-12232.【link】
好熱性ロドプシンの構造ー高い熱安定性と光遺伝学機能の考察:生物は、ロドプシンと呼ばれる光受容タンパク質を使って、情報変換やエネルギー産生を行います。近年、ロドプシン生物学的な興味に加えて、光で生命現象を操作する技術である光遺伝学(オプトジェネティクス)のツールとしても注目されています。本研究では2013年に私達が見出した、好熱性微生物由来のロドプシン(TR)の三次元構造を2.8Å分解能で明らかにし、変異体実験、分子動力学計算、光神経抑制解析など、様々な観点からその性質を検討しました。その結果、TRが他のロドプシンより遙かに熱に対して安定であること、光遺伝学においてこれまでで最も高い活性を示すこと、実験結果と理論的考察を融合し、高い安定性の原因を原子レベルで明らかにすること、などに成功しました。(千葉大学・村田武士博士らとの共同研究, 薬学科5年生・本田尚也くんの成果を含む)【*2016年6月3日号の科学新聞に取り上げて頂きました】
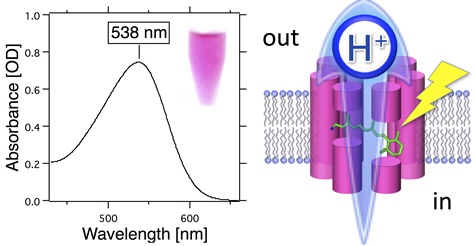
◎ *Sudo Y, *Yoshizawa S. "Functional and photochemical characterization of a light-driven proton pump from the gammaproteobacterium Pantoea vagans" (2016) Photochem.Photobiol. 92, 420-427.【link】
新しい光駆動プロトンポンプの発見:全ての生物は、細胞内外にプロトン(H+)の濃度勾配を形成し、それを駆動力に、エネルギー通貨とも呼ばれるATPを合成します。本研究では、植物着生微生物から、光駆動のH+ポンプタンパク質(PvRと命名)を発見し、その分光学的性質を解析しました。その結果、PvRは緑色光を吸収しATPを合成していることがわかりました。植物はクロロフィルを利用し青・赤色光でATPを合成しますので、両者が異なる色の光を利用し、共存していることが明らかとなりました。
◎ Iyer ES, Misra R, Maity A, Lioubashevski O, Sudo, Y, Sheves M, *Ruhman S. "Temperature independence of ultrafast photo-isomerization in thermophilic rhodopsin: Assessment vs other microbial proton pumps" (2016) J. Am. Chem. Soc. 138, 12401-12407. 【link】(The Hebrew University・Ruhman 博士らとの共同研究)
◎*Sakamoto A, Tsukamoto T, Furutani Y, Sudo Y, Shimada K, Tomita A, Kiyoi H, Kato T, Funatsu T. "Live-cell single-molecule imaging of the cytokine receptor MPL for analysis of dynamic dimerization" (2016) J. Mol. Cell Biol. 8, 553-555. 【link】(名古屋大学・坂本明彦 博士、東京大学・船津高志 博士らとの共同研究)
■2015年
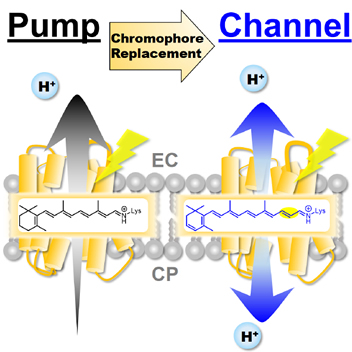
◎Inoue K, Tsukamoto T. Shimono K, Suzuki Y, Miyauchi S, Hayashi S, Kandori H, *Sudo Y. "Converting a light-driven proton pump into a light-gated proton channel" (2015) J. Am. Chem. Soc. 137, 3291-3299.
光応答性イオンチャネルの創成:生物の活動は電気の流れ(電位)により制御されています。全ての生物には、電荷(イオン)を濃度勾配に逆らって運ぶタンパク質(イオンポンプ)と濃度勾配に従って運ぶタンパク質(イオンチャネル)が存在し、これらが電位を制御しています。 本研究では、光応答性のイオン輸送体に着目し、タンパク質工学的に三つのアミノ酸残基を置換することで、光開閉性のイオンチャネルを創成することに成功しました。これにより、ポンプとチャネルの違いは、わずかな構造的な違いにより決定されていることが明らかとなりました。光で神経活動を制御し、うつ病をはじめとする神経疾患への適用や新薬の開発につなげたいと考えています。(名古屋工業大学・井上圭一博士らとの共同研究)【読売新聞(2/25), 山陽新聞(2/25), 化学工業日報(2/25), マイナビニュース(2/27), 日刊工業新聞(3/12) などで取り上げて頂きました】
◎ Kato HE, Kamiya M, Sugo S, Ito J, Taniguchi R, Orito A, Hirata K, Inutsuka A, Yamanaka A, Maturana AD, Ishitani R, Sudo Y, *Hayashi S, *Nureki O. "Atomistic design of microbial opsin-based blue-shifted optogenetics tools" (2015) Nat. Commun. 6, 7177.
青色光受容型レチナールタンパク質の合理的設計:近年、生物個体の脳神経回路を光により制御し、その機構の解明や操作が行われています(通称、オプトジェネティクス)。ここでは、2013年に発表した青色光での神経抑制ツールの開発を参考に、神経興奮の青色光での制御を試みました。理論と実験の融合により、デザインー実証が上手く進み、20~100 nmまでの色変化を自在に操ることができることを実証しました。(東京大学・濡木理 教授、京都大学・林重彦 教授らとの共同研究, *Nature Japanの注目の論文に取り上げて頂きました)
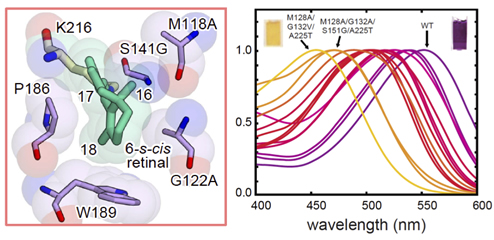
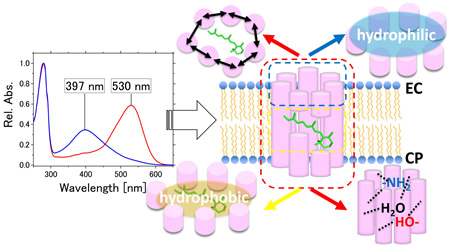
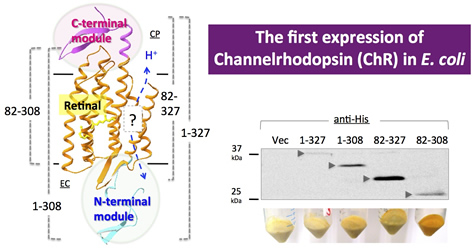
◎ Doi S, Mori A, Tsukamoto T, Reissig L, Ihara K, *Sudo Y. "Structural and functional roles of the N- and C-terminal extended modules in channelrhodopsin-1" (2015) Photochem. Photobiol. Sci. 14, 1628-1636.
イオンチャネルの末端モジュールの役割:2012年に報告された光開閉型イオンチャネル(チャネルロドプシン)の結晶構造において、他のレチナールタンパク質にはない構造的特徴(NおよびC末端に存在する構造モジュール)が見出されました(図)。本研究では、このモジュールの役割を明らかにするため、NおよびC末端欠失変異体を作成し、分光学的性質や機能を解析しました。その結果、2つのモジュールが、ChRに特徴的な性質(発現、光サイクル反応、荷電性残基のpKa)の維持に必須であることが明らかとなりました。また、この欠失体は光刺激によるイオン透過活性を失う一方で、光刺激とは関係なく恒常的イオン透過活性を示すことが明らかとなりました。(創薬科学科4年:土井 聡子さんの成果)
◎ *Dalgleish S, *Reissig L, Sudo Y, *Awaga K. "On-Tip photodetection: A simple and universal platform for optoelectronic screening" (2015) Chem. Commun. 51, 16401-16404.【link】(名古屋大学・阿波賀邦夫 教授らとの共同研究)
◎ *Dalgleish S, Reissig L, Hu L, Matsushita MM, Sudo Y, *Awaga K. "Factors affecting the stability and performance of ionic liquid-based planar transient photodetectors" (2015) Langmuir 31, 5235-5243.【link】(名古屋大学・阿波賀邦夫 教授らとの共同研究)
■2014年
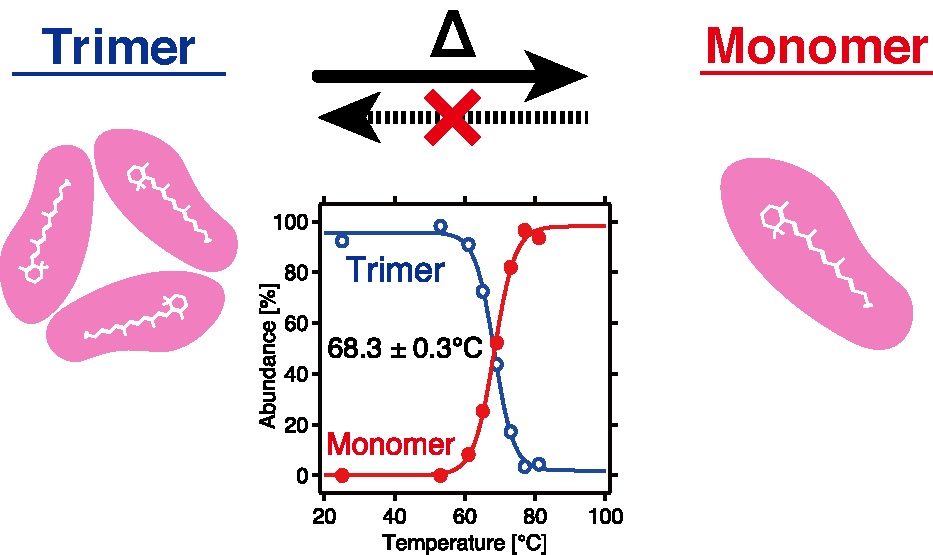
◎ Tsukamoto T, Demura M, *Sudo Y. “Irreversible trimer to monomer transition of thermophilic rhodopsin upon thermal stimulation” (2014) J. Phys. Chem. B 118, 12383-12394.
膜タンパク質の構造転移:2013年に発見した好熱耐性レチナールタンパク質(TRと命名)が、生理温度付近(転移温度~68 ºC)で三量体から単量体に不可逆的に転移することを見出しました。また、この性質は他の細菌型レチナールタンパク質にも保存されていることもわかりました。光スウィッチ分子としての応用が考えられます。
◎ Yomoda H, Makino Y, Tomonaga Y, Hidaka T, *Kawamura I, Okitsu T, Wada A, *Sudo Y, *Naito A. “Color discriminating retinal configurations of sensory rhodopsin I by photo-irradiation solid state NMR spectroscopy” (2014) Angew. Chem. Int. Ed. 53, 6960-6964.
NMRで中間状態をみる:核磁気共鳴(NMR)分光法は、天然物からタンパク質、粉末から溶液まで幅広い試料から構造情報が得られる優れた手法です。一方で、感度の悪さから短時間で起こる反応の解析には向きません。ここでは、固体NMR法において、①光受容タンパク質の高純度・高濃度試料に、②連続光による疑似平衡状態を実現することで、1秒以内に崩壊する中間体の解析に成功しました。これにより、これまで異性化と考えられていた反応がプロトン移動であることがわかりました。(*横浜国立大学・内藤晶博士らとの共同研究:*Wileys社の電子ジャーナルの世界の分光法で取り上げられました)
-
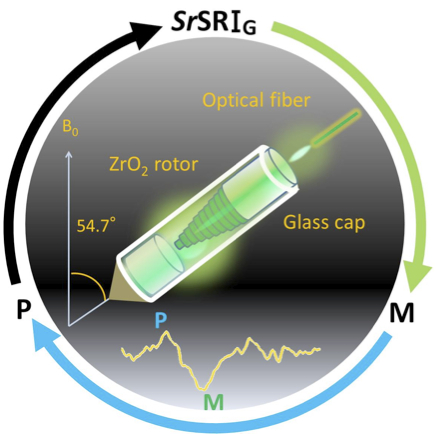
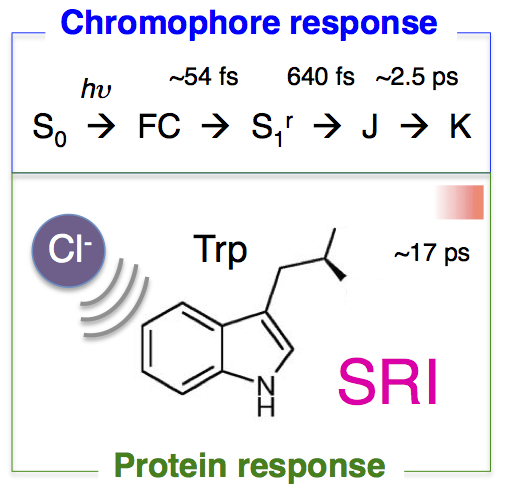
◎ *Sudo Y, Mizuno M, Wei Z, Takeuchi S, *Tahara T, *Mizutani Y. “The early steps in the photocycle of a photosensor protein sensory rhodopsin I from Salinibacter ruber” (2014) J. Phys. Chem. B 118, 1510-1518.
-
超高速反応をしらべる:ピコ秒~フェムト秒(1兆分の1~1,000兆分の1秒)レーザーを使って、誘因光センサー・SrSRIに起こる反応をしらべました。具体的には、①超短パルスレーザーと超高速蛍光分光法を用いて、発色団レチナールの励起状態とその後の状態変化を、②ラマン分光法を用いて、タンパク質内・トリプトファン残基の構造変化とCl-結合の影響を明らかにしました。(*大阪大学・水谷泰久/水野操博士、理化学研究所・田原太平博士らとの共同研究)
■2013年
-
◎ Tsukamoto T, Inoue K, Kandori H, *Sudo Y. “Thermal and spectroscopic characterization of a proton pumping rhodopsin from an extreme thermophile” (2013) J. Biol. Chem. 288, 21581-21592.

-
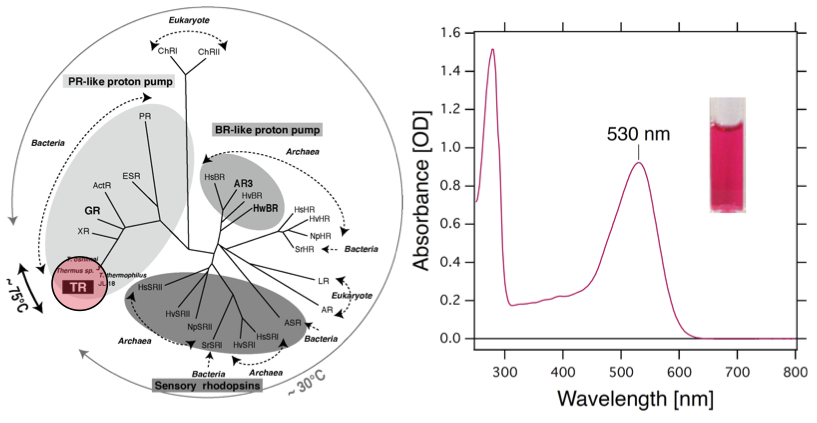
高安定性レチナールタンパク質の発見:レチナール(ビタミンAのアルデヒド型)は熱で壊れやすいため、これまで好熱性生物にはレチナールタンパク質はないと考えられてきました。ここでは、米国の温泉に生息する超好熱菌から、光駆動プロトンポンプを発見し、Thermophilic rhodopsin (TR)と名付けました。タンパク質内に取り込まれることでレチナールが安定化されているようです。光操作や材料工学への展開が期待されます。
-
◎ *Sudo Y, Okazaki A, Ono H, Yagasaki J, Sugo S, Kamiya M, Reissig L, Inoue K, Ihara K, Kandori H, Takagi S, Hayashi S. “A blue-shifted light-driven proton pump for neural silencing” (2013) J. Biol. Chem. 288, 20624-20632.
-
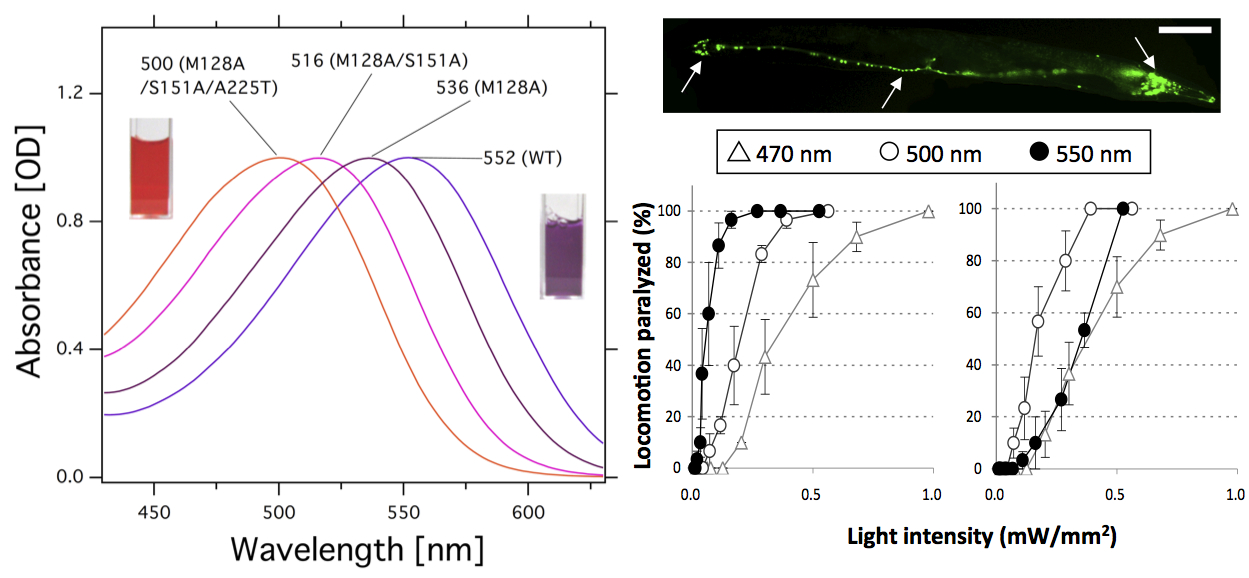
青色光受容型分子の創成と動物の行動抑制:2012年(Okazaki et al., PLoS ONE)に、光駆動プロトンポンプであるAR3を使って、モデル動物・線虫の行動を「緑色光」で止めることに成功しました。本論文では、これまでの色研究を礎にイオン輸送能を失わない「青色光」吸収型変異AR3を実験的に作成し、理論的にその原因を明らかにしました。さらに、この分子を発現した線虫が、青色光で行動が効率的に止まることも実証しました。(*名古屋大学・高木新博士、京都大学・林重彦博士らとの共同研究)
-
◎ Mori A, Yagasaki J, Homma M, Reissig L, *Sudo Y. “Investigation of the chromophore binding cavity in the 11-cis acceptable microbial rhodopsin MR” (2013) Chem. Phys. 419, 23-29.
-
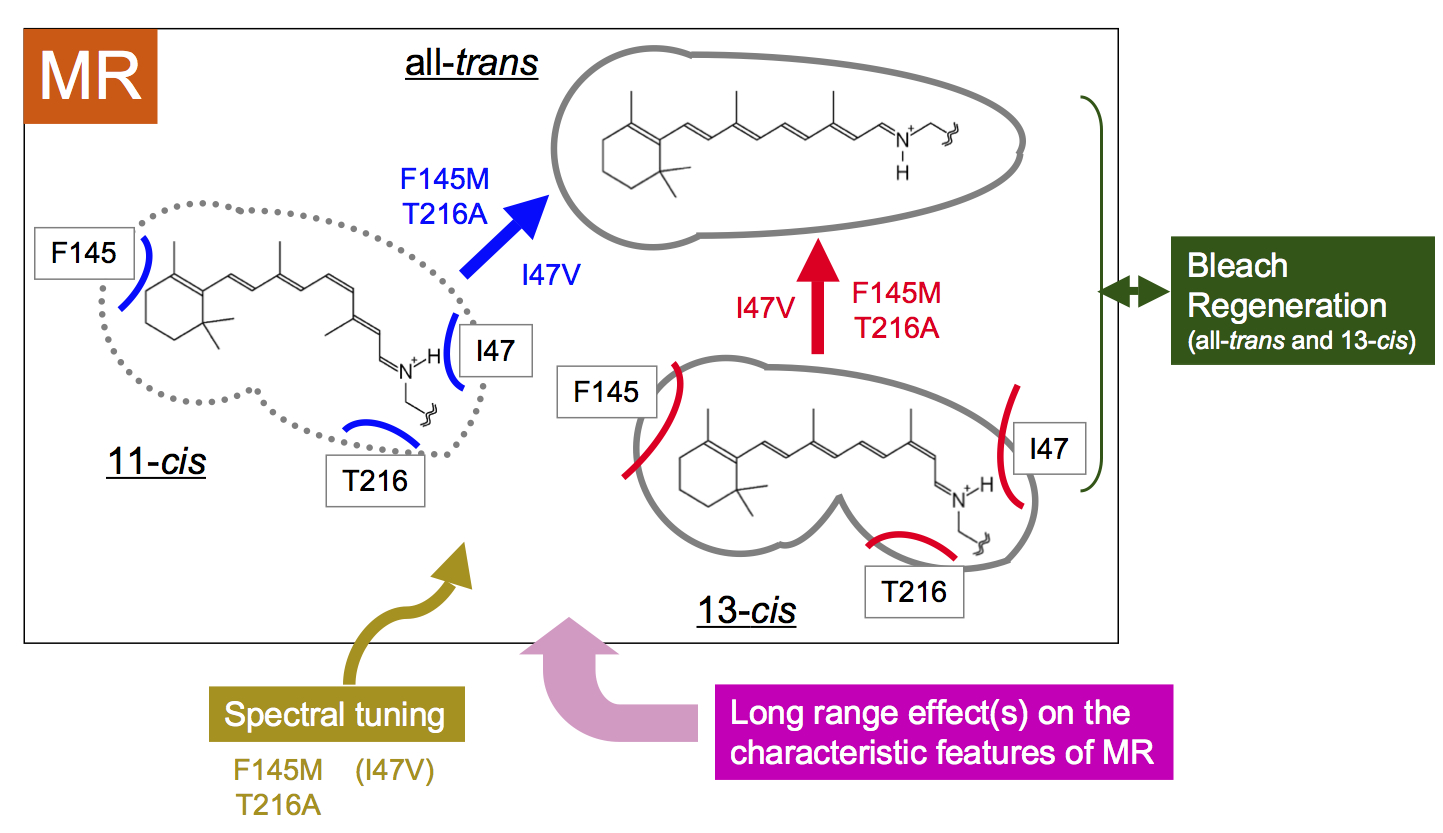
発色団結合部位の形を探る:2011年(Sudo et al., J. Biol. Chem.)に見出した新しい光受容分子・MRは、動物型分子と同様に11-cis型の発色団を持つ特徴がありました。ここでは、9-cis, 13-cis, all-trans型のレチナールが空のMR(オプシンと呼びます)に取り込まれる速度を解析し、レチナール結合部位の構造柔軟性をしらべるとともに、特徴的なアミノ酸に変異を導入しそれらの寄与をしらべました。(*学部4年生・森有梨沙さんの卒論研究)
-
◎ *Furutani Y, Okitsu T, Reissig L, Mizuno M, Homma M, Wada A, Mizutani Y, *Sudo Y. “Large spectral change due to amide modes of a β-sheet upon the formation of an early photointermediate of middle rhodopsin” (2013) J. Phys. Chem. B 117, 3449-3458.
-
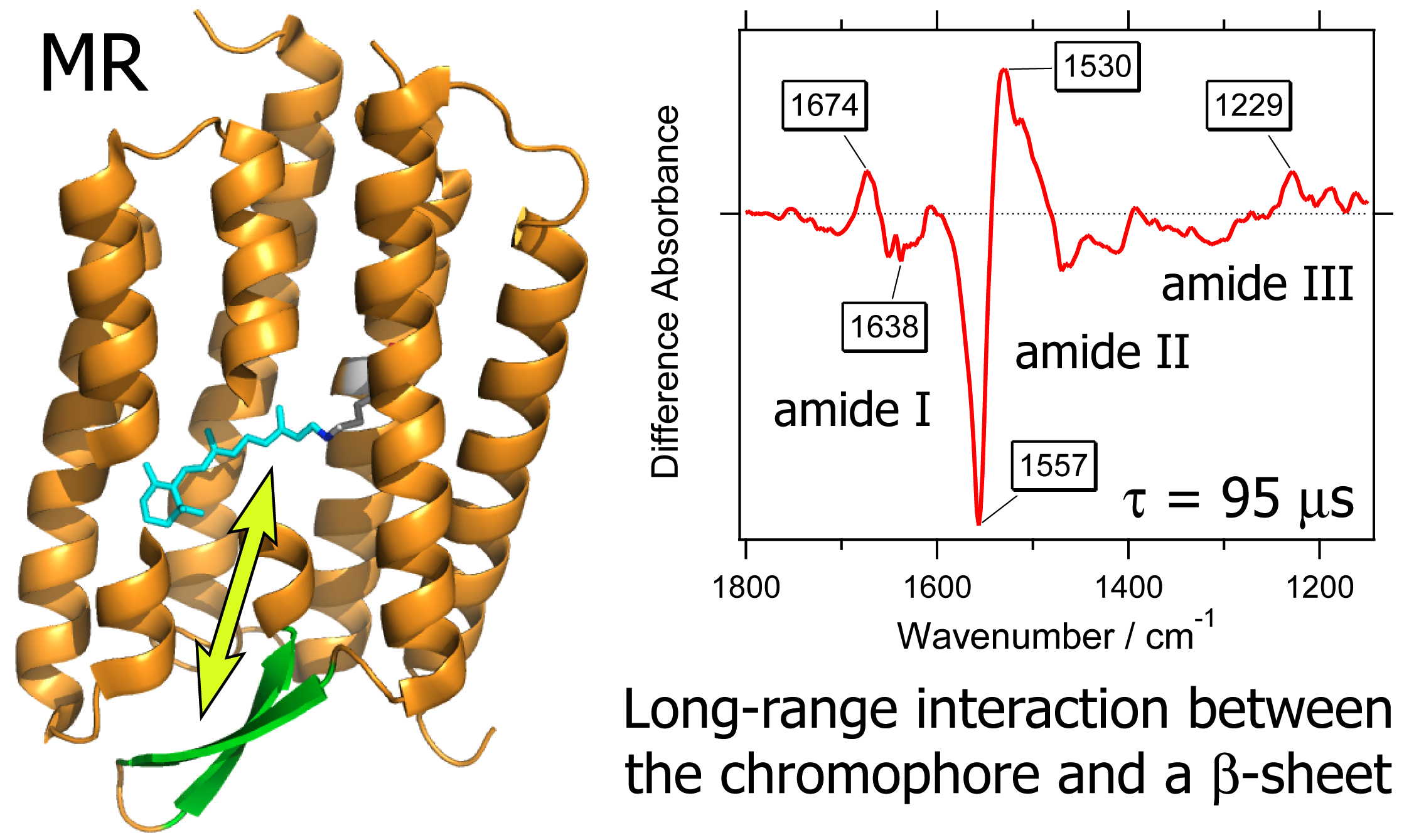
タンパク質の構造変化を時間分解FTIRでみる:2011年(Sudo et al., J. Biol. Chem.)に見出した新しい光受容分子・MRの光刺激に伴う構造変化を、時間分解フーリエ変換赤外(FTIR)分光法により解析しました。その結果、95µsの時定数でβシートが構造変化を起こすことがわかりました。これまで見つかっているレチナールタンパク質には見られない特徴的な性質で、この分子の生理機能と関係があるものと考えています。(*分子科学研究所・古谷祐詞博士、神戸薬科大学・和田昭盛博士らとの共同研究)
■2012年
-
◎ Reissig L, Iwata T, Kikukawa T, Demura M, Kamo N, Kandori H, *Sudo Y. “The influence of halide binding on the hydrogen bonding network in the active site of Salinibacter sensory rhodopsin I” (2012) Biochemistry 51, 8802-8813.
- アニオン結合による光センサーの構造変化:緑色光誘因センサー・SRIのハライド結合による構造および構造変化に及ぼす影響を、低温フーリエ変換赤外(FT-IR)分光法とガラス透明電極を用いた電気化学的測定により調べました。その結果、ハライド結合によりD102のプロトン移動が阻害されること、水分子の構造変化が誘起されること、電気信号が消失すること、などが明らかになりました。これをもとに光反応サイクル中の構造と構造変化を考察しました。 (北海道大学・菊川峰志博士、名古屋工業大学・神取秀樹博士らとの共同研究)
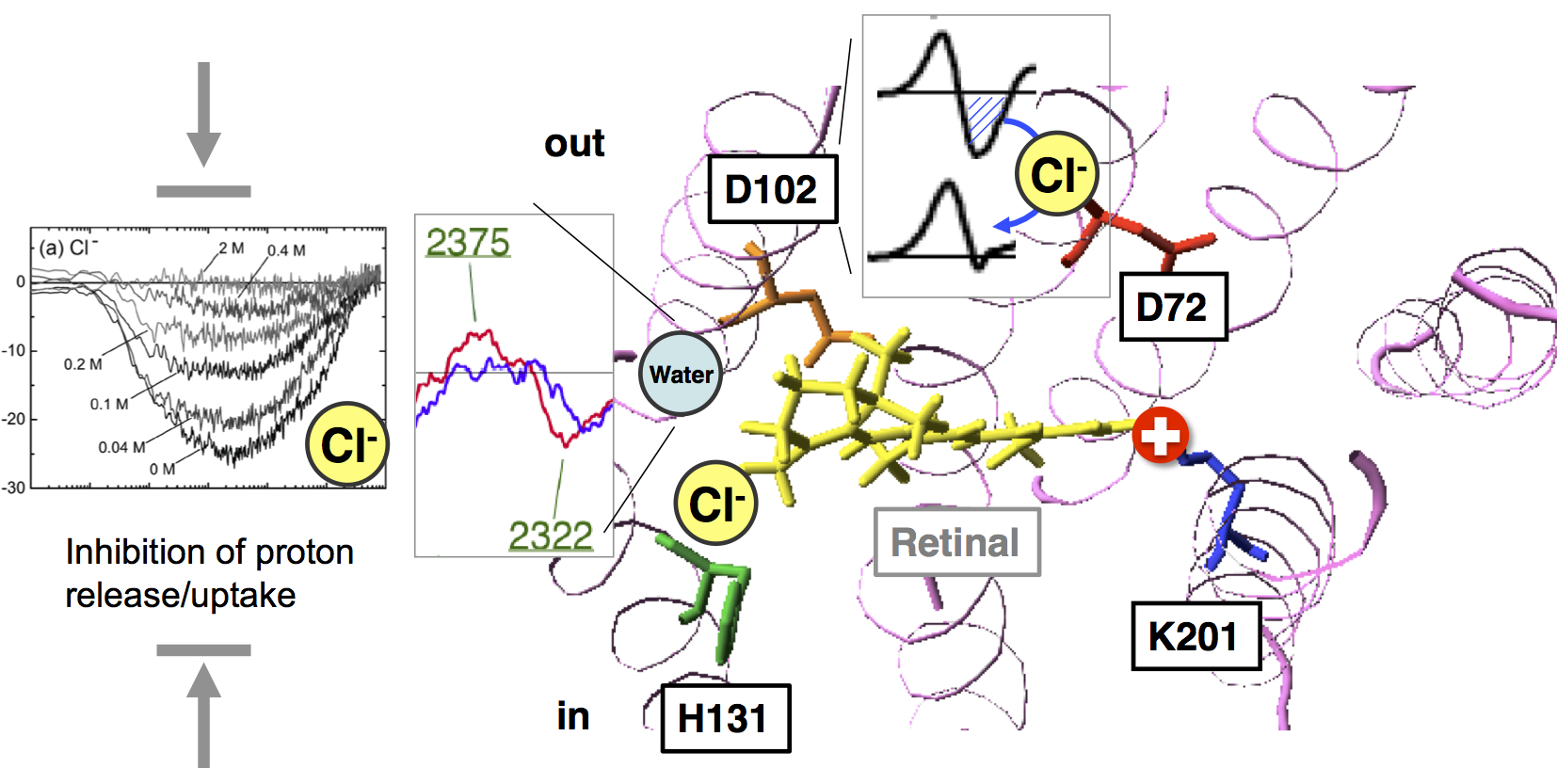
-
◎ Irieda H, Morita T, Maki K, Homma M, Aiba H, *Sudo Y. “Photo-induced regulation of the chromatic adaptive gene expression by Anabaena sensory rhodopsin” (2012) J. Biol. Chem. 287, 32485-32493.
レチナールタンパク質の新しい機能ー光転写調節:藍藻・アナベナから2003年に見出されたアナベナセンサリーロドプシン(ASR)は、種々の分光学的・構造生物学的解析が進んでいるにもかかわらず、その生理機能はよくわかっていませんでした。私達は分子生物学的手法を用いて、ASRが暗中で光合成色素の発現を負に制御し、光により解除されるという新しい機能・光転写調節を明らかにしました。(鈴鹿医療科学大学・饗場弘二博士との共同研究)
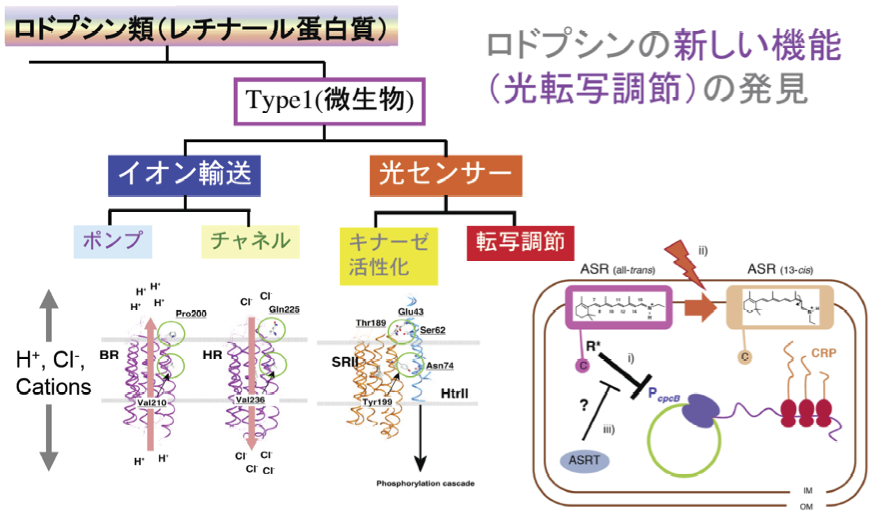
-
◎ Inoue K, Reissig L, Sakai M, Kobayashi S, Homma M, Fujii M, Kandori H, *Sudo Y. “Absorption spectra and photochemical reactions in a unique photoactive protein, middle rhodopsin MR” (2012) J. Phys. Chem. B 116, 5888-5899.
3状態を分光学的に分離する:2011年(Sudo et al., J. Biol. Chem.)に見出した新しい光受容分子・MRは、電子基底状態(暗状態)で、3つの状態を取ることがわかっています。それらを分光学的に分離するため、①様々な条件での可視吸収スペクトルを測定し、それぞれのスペクトルを満たす3つの固有スペクトルを決定し、②それぞれの吸収極大とモル吸光係数の違いを利用し、パルスレーザーによる吸収変化の波長依存性から、3つの反応時定数と反応サイクルを決定しました。(東京工業大学・藤井正明/酒井誠博士、名古屋工業大学・神取秀樹博士との共同研究)
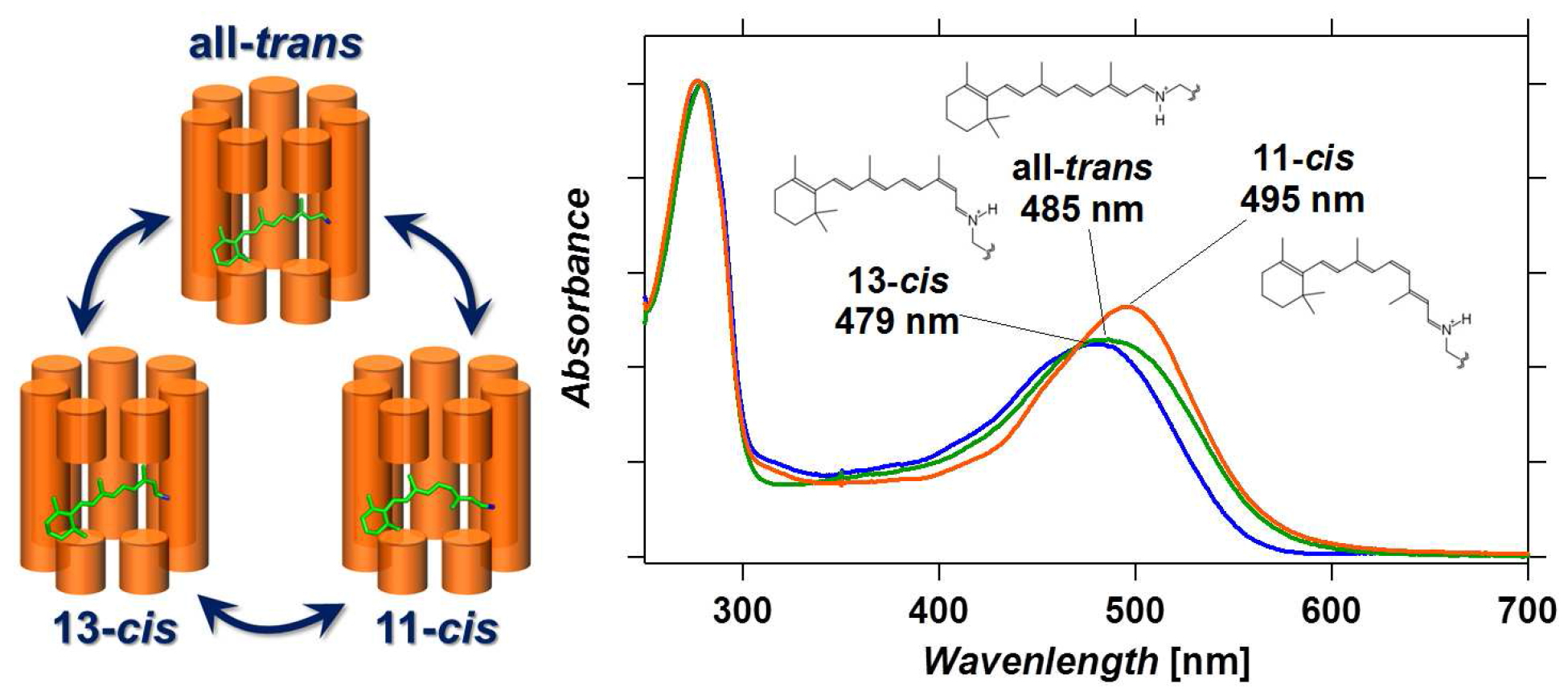
■2011年
-
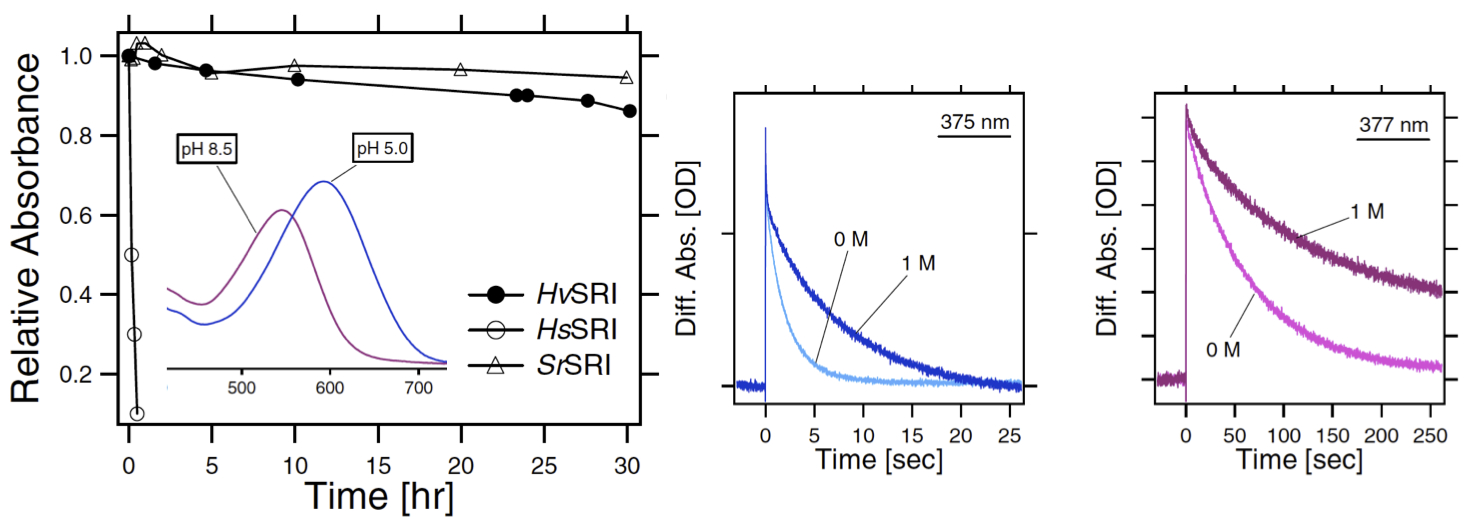
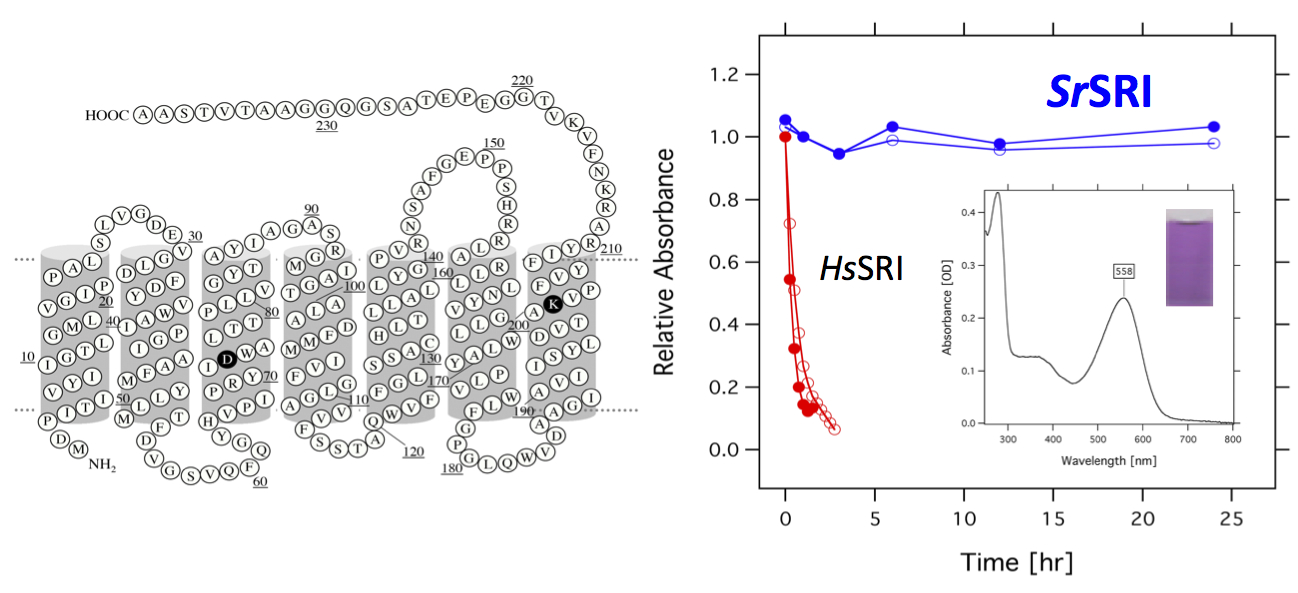
◎ *Sudo Y, Yuasa Y, Shibata J, Suzuki D, Homma M. “Spectral tuning in sensory rhodopsin I from Salinibacter ruber” (2011) J. Biol. Chem. 286, 11328-11336.
色を決めるアミノ酸残基:生物は紫外線を含む短波長の光を「嫌いな物」として、エネルギーを作る長波長の光を「好きな物」として認識します。その波長の違いを認識するために、色が異なる光受容体を持っています。ここでは、短波長(青)を認識するセンサリーロドプシンII(SRII)と長波長(緑)を認識するセンサリーロドプシンI(SRI)の色識別機構を明らかにするため、「長波長型」SRIIと「短波長型」SRIを合理的変異導入により作成しました。これにより、色を決める要因を同定し、様々な色を呈する光受容体をデザインするための設計図を手にしました。(*学部4年生・湯浅恭史くんの卒論研究)

-
◎ *Sudo Y, Ihara K, Kobayashi S, Suzuki D, Irieda H, Kikukawa T, Kandori H, Homma M. “A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties” (2011) J. Biol. Chem. 286, 5967-5976.
-
ミドルロドプシン(MR)の発見:生物は、光をエネルギー源もしくは情報源として利用するための光受容体を発達させています。レチナールタンパク質は、光エネルギー変換(イオンポンプ)と光情報変換(光センサー)の両方を機能とします。これまでに、イオンポンプと光センサー間で、相互機能変換が可能であることから(Sudo et al., 2001, Biophys. J., 2006, PNAS)、両者には分子進化的なつながりがあると考えてきました。ここでは、分子系統樹においてBRとSRIIの中間に位置する分子を、正方形の古細菌から見出し、ミドルロドプシン(MR)と名付けました。その光反応はポンプとよく似ていること、色や機能面ではセンサーとよく似ていることがわかりました。そのため、分子進化の過程で色や機能面が最初に最適化され、その後光反応やその他の性質が変化したものと考えられます。(*名古屋大学・井原邦夫博士らとの共同研究)
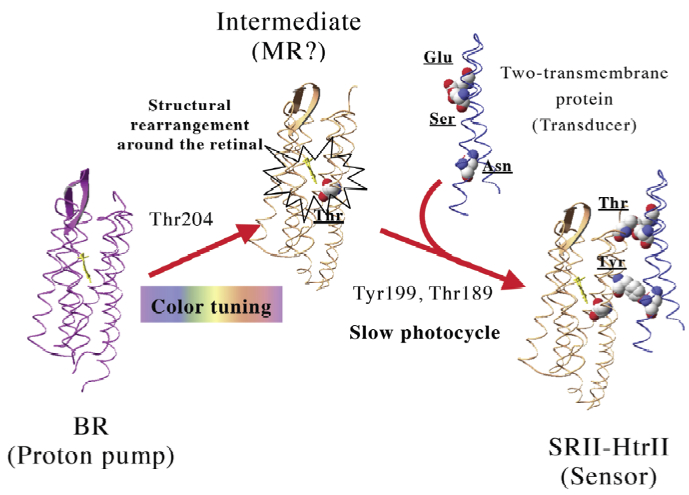
-
◎ Irieda H, Reissig L, Kawanabe A, Homma M, Kandori H, *Sudo Y. “Structural characteristics around the β-Ionone ring of the retinal chromophore in Salinibacter sensory rhodopsin I” (2011) Biochemistry 50, 4912-4922.
-
光センサー・SRIの構造特性:微生物は、好ましい物(栄養物や最適温度など)への誘因センサーと、好ましくない物(毒や極端なpHなど)からの忌避センサーを持っています。ここでは、好ましい波長の光に集まるための誘因センサーであるセンサリーロドプシンIの構造変化を、低温フーリエ変換赤外(FT-IR)分光法により調べました。その結果、通常、非常に疎水的な部位である発色団レチナールのβイオノン環付近が親水的な環境になっており、逆に通常は親水的な部位であるシッフ塩基近傍が疎水的になっていること、それらが情報伝達分子(HtrI)との相互作用により大きく変化することがわかりました。(名古屋工業大学・神取秀樹博士らとの共同研究)
-
◎ *Sudo Y, Tanaka R, Kobayashi T, Kamo N, Kohno T, Kojima C. “Functional expression of a two-transmembrane HtrII protein using cell-free synthesis” (2011) Biophysics 7, 51-58.
-
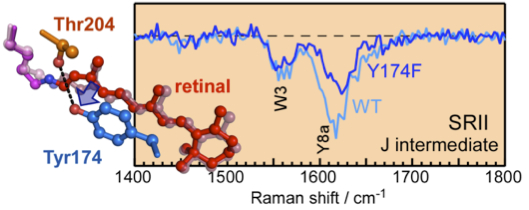
◎ Mizuno M,† Sudo Y,† Homma M, *Mizutani Y. (†equal contribution) “Direct observation of the structural change of Tyr174 in the primary reactions of sensory rhodopsin II” (2011) Biochemistry 50, 3170-3180.
-
光センサーに重要なTyr174の構造変化:青色光の忌避センサーであるセンサリーロドプシンIIの機能には2つのアミノ酸残基、Thr204とTyr174が重要です。Thr204についてはその分子論的意義がわかってきましたが、Tyr174については不明で、米国ポスドク時代に積み残した宿題となっていました。ここでは、TyrやTrpなどの芳香族アミノ酸の解析に優れた、紫外共鳴ラマン分光法によって、ピコ秒領域でTyr174の構造が変化することを突き止めました。宿題を助けて頂いた大阪大学・水谷泰久/水野操博士に深く感謝いたします。
■2010年以前の主な論文
-
◎ Yagasaki J, Suzuki D, Ihara K, Inoue K, Kikukawa T, Sakai M, Fujii M, Homma M, Kandori H, *Sudo Y. “Spectroscopic studies of a sensory rhodopsin I homologue from the archaeon Haloarcula vallismortis” (2010) Biochemistry 49, 1183-1190.
-
◎ *Sudo Y, Okada A, Suzuki D, Inoue K, Irieda H, Sakai M, Fujii M, Furutani Y, Kandori H, Homma M. “Characterization of a signaling complex composed of sensory rhodopsin I and its cognate transducer protein from the eubacterium Salinibacter ruber” (2009) Biochemistry 48, 10136-10145.
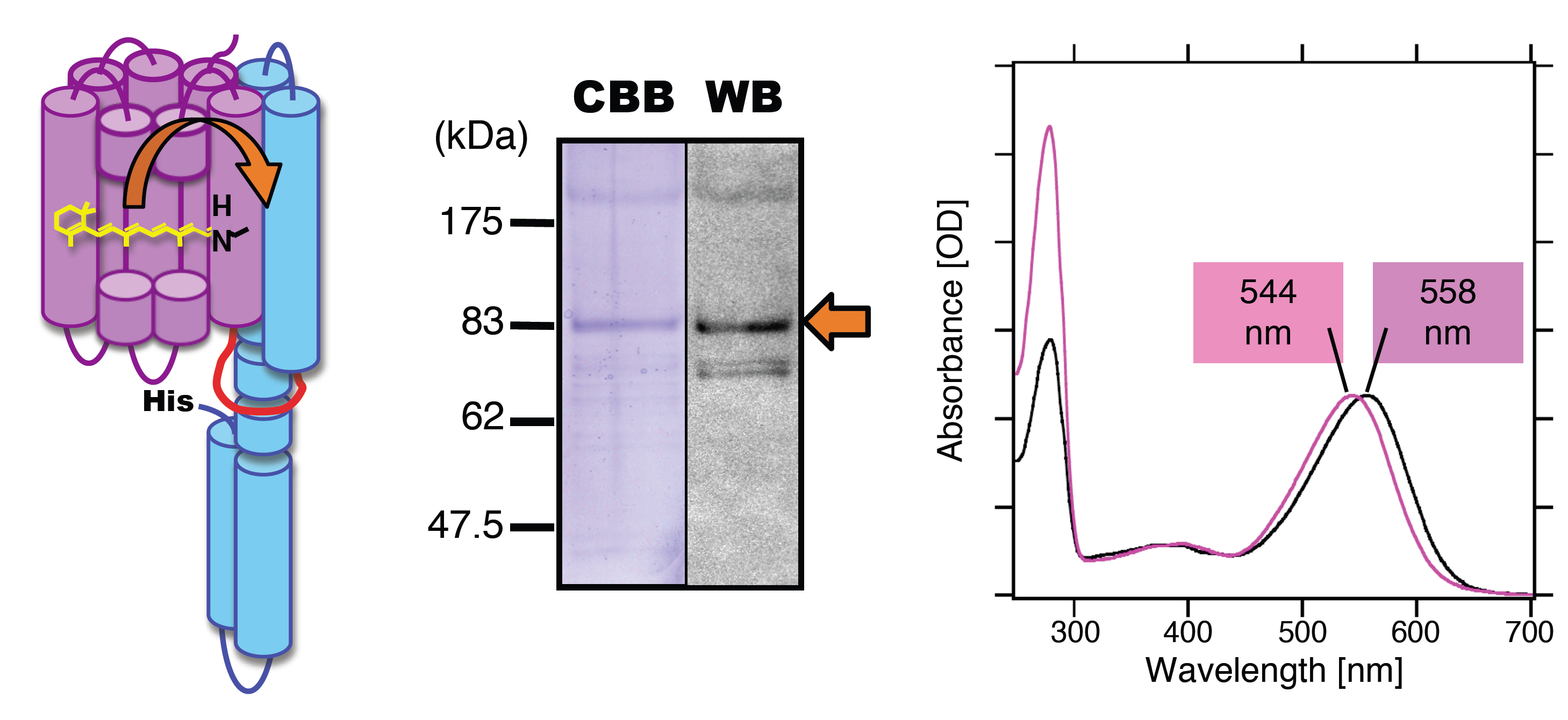
(*学部4年生・岡田亜希子さんの卒論研究です。光センサーと共役タンパク質の全長を精製するという10年来の希望を達成して頂きました)
-
◎ Suzuki D, Furutani Y, Inoue K, Kikukawa T, Sakai M, Fujii M, Kandori H, Homma M, *Sudo Y. “Effects of chloride ion binding on the photochemical properties of Salinibacter sensory rhodopsin I” (2009) J. Mol. Biol. 392, 48-62.【朝日新聞7/15, 科学新聞7/24, 中日新聞7/19, 時事通信7/14, 共同通信7/18】
(*2008年に博士後期課程1年で加わってくれた鈴木大介さんの成果。誘因光センサー・センサリーロドプシンI(SRI)へのCl-結合による新しい色制御メカニズムの発見と、センサー機能への重要性を明らかにしてくれました。卒業までの3年間でこの他に6つの原著論文に貢献してくれました)
-
◎ Kitajima-Ihara T, Furutani Y, Suzuki D, Ihara K, Kandori H, Homma M, *Sudo Y. “Salinibacter sensory rhodopsin: Sensory rhodopsin I-like protein from a eubacterium” (2008) J. Biol. Chem. 283, 23533-23541.
(*技術補助員・北島智美さんに助けて頂きました。生物の三大ドメインのうち、古細菌にしかないと思われていた光誘因センサー・センサリーロドプシンIを真正細菌から発見し、SrSRIと名付けました。これまでのSRIに比べて1万倍以上も安定で、SRIの機能解析への礎となっています)
-
◎ Sudo Y, Furutani Y, *Spudich JL, *Kandori H. "Early photocycle structural changes in a bacteriorhodopsin mutant engineered to transmit photosensory signals" (2007) J. Biol. Chem. 282, 15550-15558.【表紙論文, 日刊工業新聞5/14, 日経BP】

(*光センサーに変換した分子の構造をFT-IRで調べました。表紙に載せて頂きました)
-
◎ Sudo Y, *Spudich JL. "Three strategically placed hydrogen-bonding residues convert a proton pump into a sensory receptor" (2006) Proc. Natl. Acad. Sci. USA 103, 16129-16134.

(*PNAS誌の解説記事に取り上げて頂きました。光センサーをアミノ酸置換により作成することに成功し、光情報変換の本質的を明らかにしました)
-
◎ Sudo Y, Furutani Y, Kandori H, *Spudich JL. "Functional importance of the interhelical hydrogen bond between Thr204 and Tyr174 of sensory rhodopsin II and its alteration during the signaling process" (2006) J. Biol. Chem. 281, 34239-34245.
-
◎ *Sudo Y, Yamabi M, Kato S, Hasegawa C, Iwamoto M, Shimono K, Kamo N. "Importance of the specific hydrogen bonds of archaeal rhodopsins for the binding to the transducer protein" (2006) J. Mol. Biol. 357, 1274-1282.
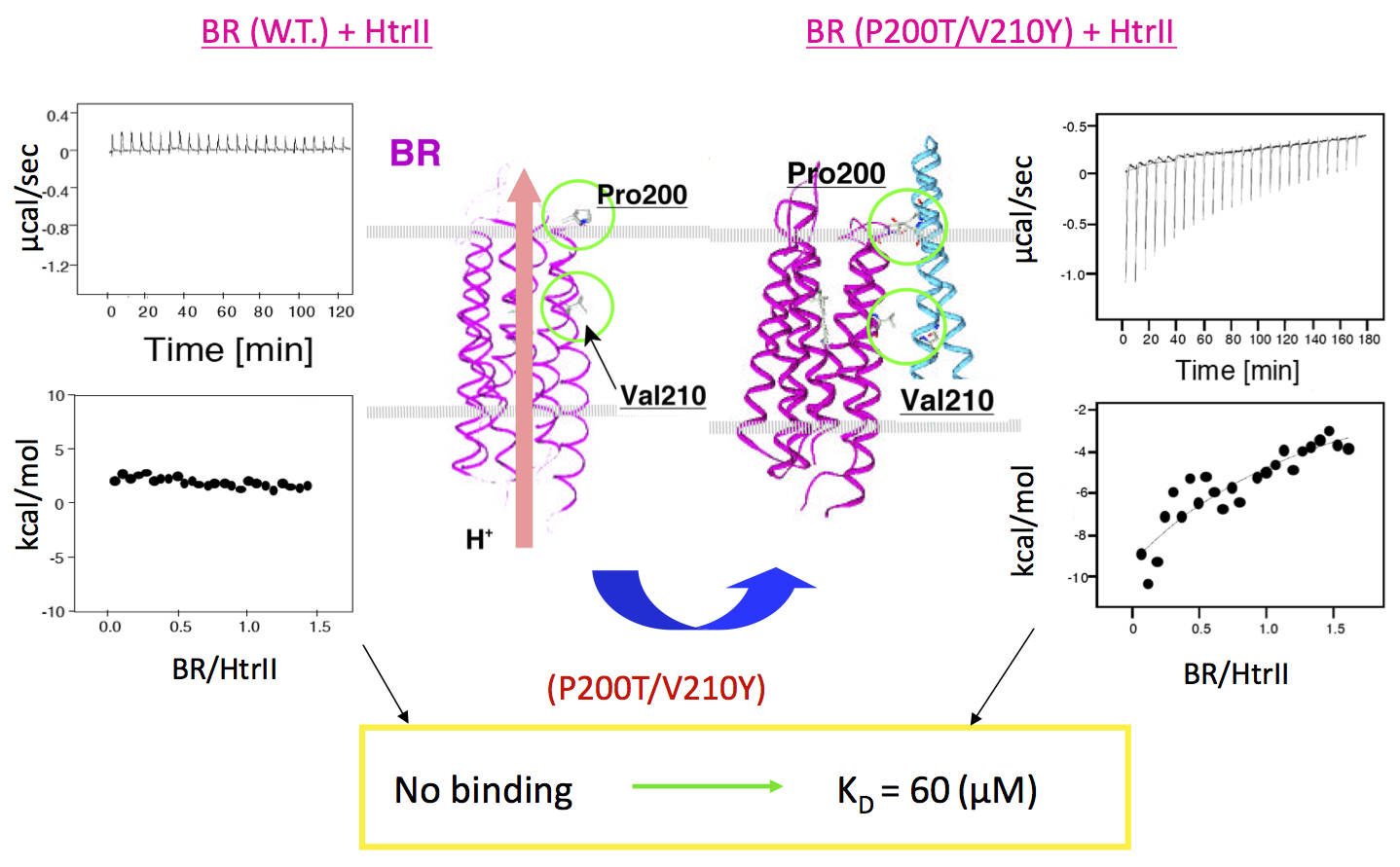
(*等温滴定型熱量計を使い、膜タンパク質間相互作用を熱力学的に解析しました。初の責任著者論文)
-
◎ Sudo Y, Furutani Y, Wada A, Ito M, Kamo N, *Kandori H. "Steric constraint in the primary photoproduct of an archaeal rhodopsin from regiospecific perturbation of C-D stretching vibration of the retinyl chromophore" (2005) J. Am. Chem. Soc. 127, 16036-16037.
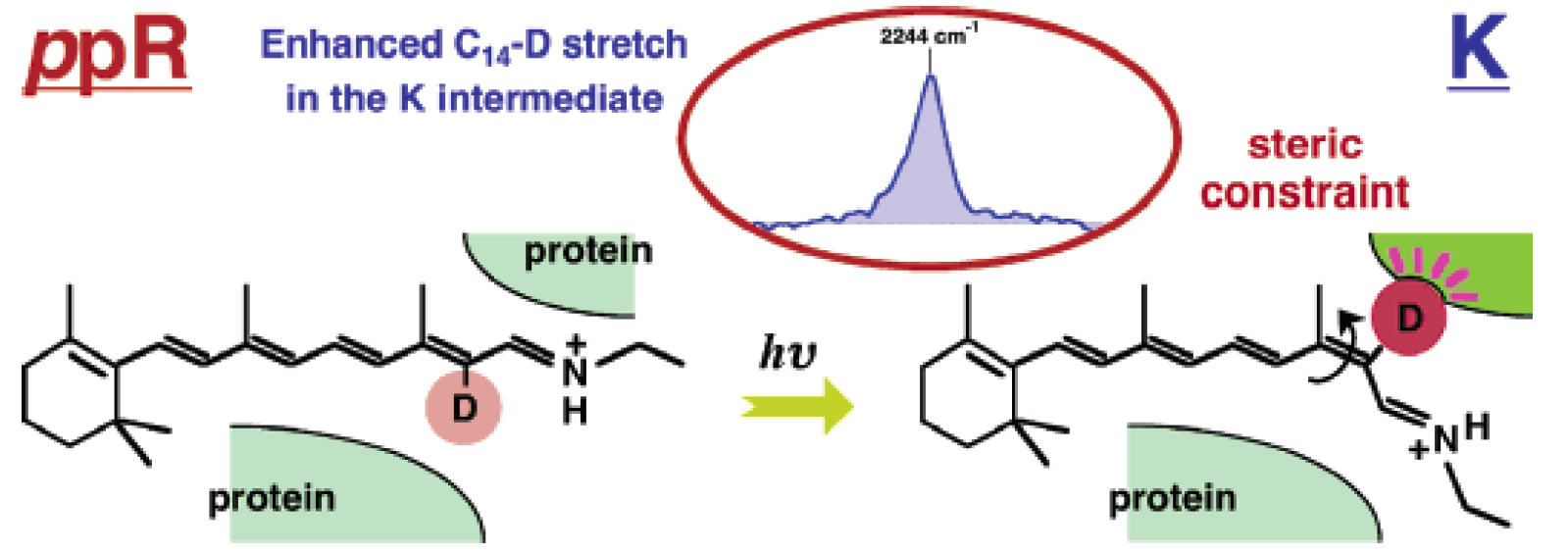
(*C-D基を発色団に導入し、立体障害のプローブとして用いた赤外分光測定の論文)
-
◎ Sudo Y, Okuda H, Yamabi M, Fukuzaki Y, Mishima M, Kamo N, *Kojima C. "Linker region of a halobacterial transducer protein interacts directly with its sensor retinal protein" (2005) Biochemistry 44, 6144-6152.
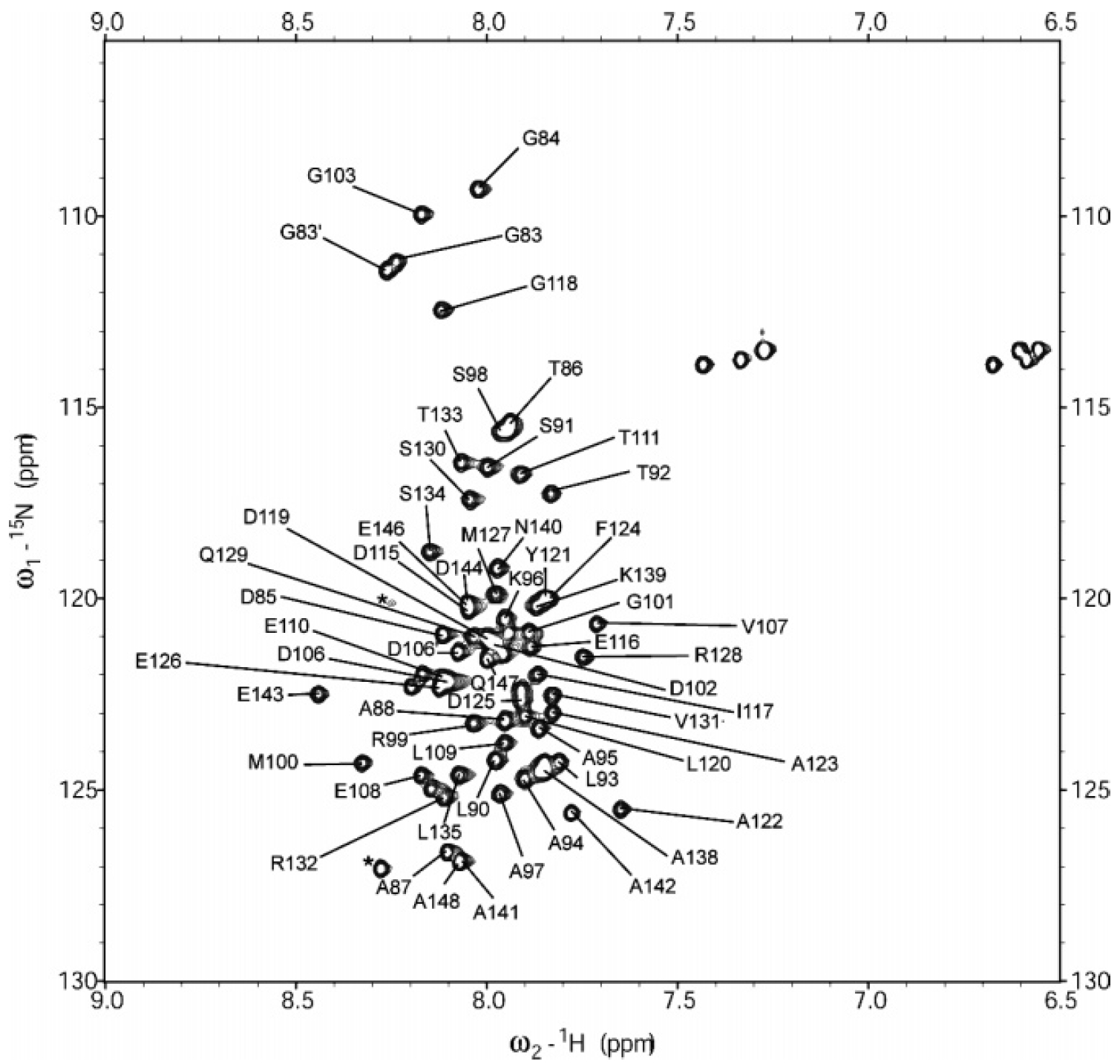
(*溶液NMR分光法と熱力学的解析により、光信号伝達タンパク質と光センサーの細胞内ループが相互作用することをアミノ酸残基レベルで確かめました。)
-
◎ Sudo Y, Iwamoto M, Shimono K, *Kamo N. "Role of charged residues of pharaonis phoborhodopsin (sensory rhodopsin II) in its interaction with the transducer protein" (2004) Biochemistry 43, 13748-13754.
-
◎ Sudo Y, Furutani Y, Shimono K, Kamo N, *Kandori H. "Hydrogen bonding alteration of Thr-204 in the complex between pharaonis phoborhodopsin and its transducer protein" (2003) Biochemistry 42, 14166-14172.
◎ Sudo Y, Yamabi M, Iwamoto M, Shimono K, *Kamo N. "Interaction of Natronobacterium pharaonis phoborhodopsin (sensory rhodopsin II) with its cognate transducer probed by increase in the thermal stability" (2003) Photochem. Photobiol. 78, 511-516.
-
◎ Sudo Y, Iwamoto M, Shimono K, *Kamo N. "Tyr-199 and charged residues of pharaonis phoborhodopsin are important for the interaction with its transducer" (2002) Biophys. J. 83, 427-432.
◎ Sudo Y, Iwamoto M, Shimono K, *Kamo N. "Association between a photo-intermediate of a M-lacking mutant D75N of pharaonis phoborhodopsin and its cognate transducer" (2002) J. Photochem. Photobiol. B 67, 171-176.
◎ Sudo Y, Iwamoto M, Shimono K, *Kamo N. "Association of pharaonis phoborhodopisn with its cognate transducer decreases the photo-dependent reactivity by water-soluble reagents of azide and hydroxylamine" (2002) Biochim. Biophys. Acta 1558, 63-69.
◎ Sudo Y, Iwamoto M, Shimono K, *Kamo N. "pharaonis phoborhodopsin binds to its cognate truncated transducer even in the presence of a detergent with a 1:1 stoichiometry"
(2001) Photochem. Photobiol. 74, 489-494.
-
◎ Sudo Y, Iwamoto M, Shimono K, Sumi M, *Kamo N. "Photo-induced proton transport of pharaonis phoborhodopsin (sensory rhodopsin II) is ceased by association with the transducer" (2001) Biophys. J. 80, 916-922.
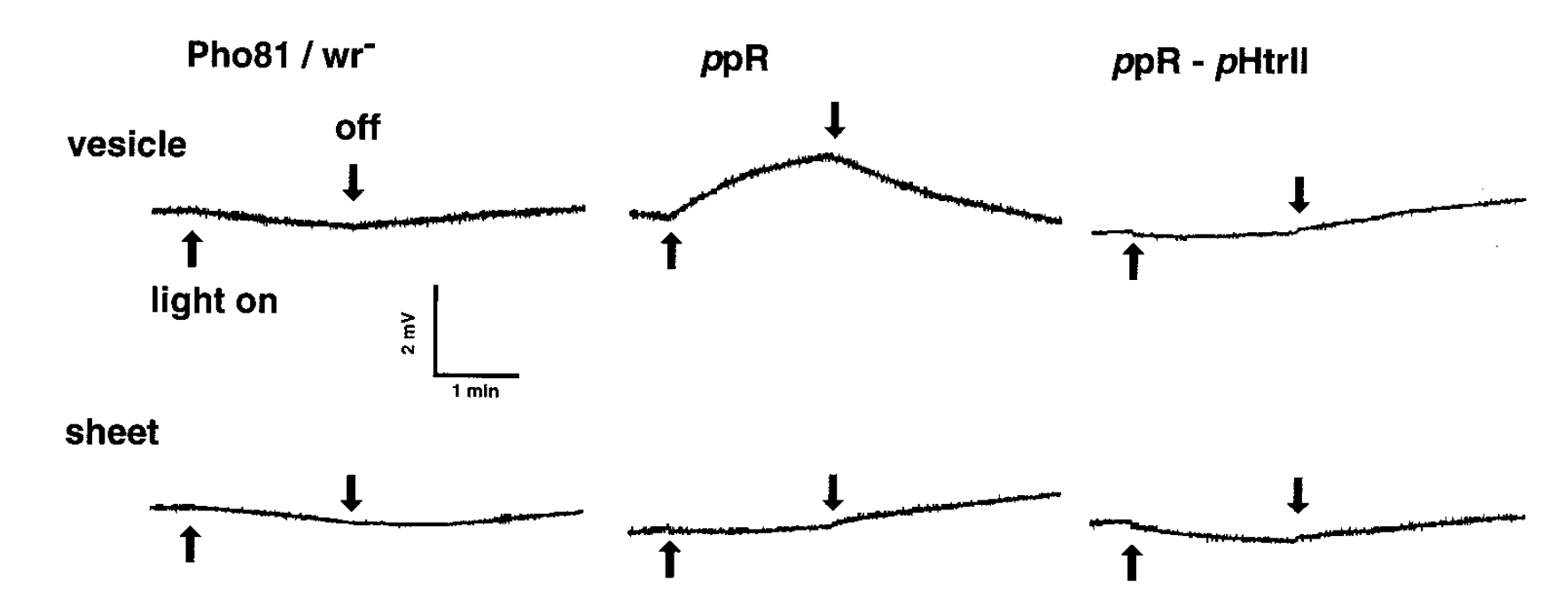
(*はじめての論文。光センサー・ppRが、2回膜貫通型タンパク質・pHtrIIと結合することで、プロトン移動が阻害されることをSnO2電極を用いて示しました。)
*全業績リストはこちら
[井上]
(1) Saito, Y., Inoue, T., Zhu, G., Kimura, N., Okada, M., Nishimura, M., Kimura, N., Murayama, S., Kaneko, S., Shigemoto, R., Imoto, K., & Suzuki, T. (2012) “Hyperpolarization-activated cyclic nucleotide gated channels: a potential molecular link between epileptic seizures and Aβ generation in Alzheimer’s disease” Mol. Neurodegener. 7, 50.
(2) Satake, S.,Inoue, T., Imoto, K. (2012) “Paired-pulse facilitation of multivesicular release and intersynaptic spillover of glutamate at rat cerebellar granule cell-interneurone synapses” J. Physiol.590, 5653-5675.
(3) Kase, D., Inoue, T., Imoto, K. (2012) “Roles of the subthalamic nucleus and subthalamic HCN channels in absence seizures” J. Neurophysiol. 107, 393-406.
[塚本]
Inoue, K., Tsukamoto, T., Shimono, K., Suzuki, Y., Miyauchi, S., Hayashi, S., Kandori, H., *Sudo, Y. "Converting a light-driven proton pump into a light-gated proton channel" (2015) J. Am. Chem. Soc.137, 3291-3299.
Tsukamoto, T., Demura, M., & *Sudo, Y. “Irreversible Trimer to Monomer Transition of Thermophilic Rhodopsin upon Thermal Stimulation” (2014) J. Phys. Chem. B 118, 12383-12394.
Tsukamoto, T., T., Inoue, K., Kandori, H., & *Sudo, Y. “Thermal and spectroscopic characterization of a proton pumping rhodopsin from an extreme thermophile” (2013) J. Biol. Chem. 288, 21581-21592.【Faculty of 1000 Biology “Recommended” 】
*Tsukamoto, T., Li, X., Morita, H., Minowa, T., Aizawa, T., Hanagata, N., *Demura, M. “Role of S-palmitoylation on IFITM5 for the Interaction with FKBP11 in Osteoblast Cells” (2013) PLoS ONE 8(9), e75831.
Tsukamoto, T., Kikukawa, T., Kurata, T., Jung, K.-H., Kamo, N., *Demura, M. “Salt-bridge in the conserved His-Asp cluster in Gloeobacter rhodopsin contributes to trimer formation” (2013) FEBS Lett. 587, 322-327.
Tsukamoto, T., Sasaki, T., Fujimoto, K. J., Kikukawa, T., Kamiya, M., Aizawa, T., Kawano, K., Kamo, N., *Demura, M. “Homotrimer formation and dissociation of pharaonis halorhodopsin in detergent system” (2012) Biophys. J. 102, 2906-2915.
Yamashita, Y., *Kikukawa, T., Tsukamoto, T., Kamiya, M., Aizawa, T., Kawano, K., Miyauchi, S., Kamo, N., Demura, M. “Expression of salinarum halorhodopsin in Escherichia coli cells: Solubilization in the presence of retinal yields the natural state” (2011) Biochim. Biophys. Acta 1808, 2905-2912.
-
[須藤]
須藤雄気 "オプトジェネティクス" (2016)光と生命の事典, 日本光生物学協会「光と生命の事典」編集委員会 編 [朝倉書店], 372-373. 【link】
須藤雄気 "光受容レチナールタンパク質の構造・機能解析:光+タンパク質=薬!? 』(2016)薬学雑誌, 136, 185-189.
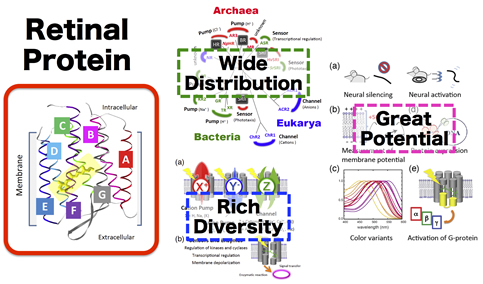
Kurihara, M., *Sudo, Y. "Microbial rhodopsins: Wide distribution, rich diversity and great potential" (2015)Biophys. Physicobiol. 12, 121-129. 【link】
-
Katayama K, Sekharan S, *Sudo Y. “Color tuning in retinylidene proteins” (2015) Optogenetics: Light-Sensing Proteins and Their Applications, Chapter 7, pp. 89-107. 【link】
-
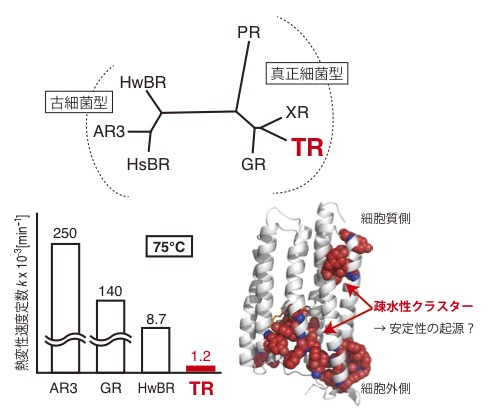
塚本卓、須藤雄気 "好熱性細菌のレチナールタンパク質" (2015)生物物理 55, 92-94.【link】
土井聡子、須藤雄気 "ビタミンAアルデヒドを発色団とするレチナールタンパク質の多様性と可能性" (2015)ビタミン 89, 83-86. 【link】
須藤雄気、神取秀樹 "オプトジェネティクス(光遺伝学)の原理と基礎" (2014)ファルマシア 50, 958-962. 【link】
須藤雄気、塚本卓 ”膜タンパク質の可溶化(抽出)(2)” (2014) 蛋白質科学会・アーカイブ, 7, e079. 【link】
Inoue K, Tsukamoto T, *Sudo Y. “Molecular and evolutionary aspects of microbial sensory rhodopsins” (2014) Biochim. Biophys. Acta 1837, 562-577.
-
Tsukamoto T, *Sudo Y. “Sensory rhodopsins” (2014) In: eLS. John Wiley & Sons, Ltd: Chichester. DOI: 10.1002/9780470015902.a0022838
-
須藤雄気 “ロドプシンの波長制御と光情報変換機構” (2013) オプトジェネティクス~光工学と遺伝学による行動制御技術の最前線~, 第2章4節, pp.79-91.
-
Sudo Y. “Transport and sensory rhodopsins in microorganisms” (2012) CRC Handbook of Organic Photochemistry and Photobiology, the 3rd edition, CRC Press, Boca Raton, pp. 1173-1193.
-
須藤雄気 他 “光受容タンパク質による微生物の光センシングの理解とその利用” (2012) 薬学雑誌 132, 407-416.
-
須藤雄気 他 “高度好塩性微生物の“目”:センサリーロドプシンへのCl-イオン結合の役割” (2011) 極限環境微生物学会誌 10, 23-29.
*2010年以前はこちら
[塚本]
須藤雄気、塚本卓 ”膜タンパク質の可溶化(抽出)(2)” (2014) 蛋白質科学会・アーカイブ, 7, e079. 【link】
Inoue K, Tsukamoto T, *Sudo Y. “Molecular and evolutionary aspects of microbial sensory rhodopsins” (2014) Biochim. Biophys. Acta 1837, 562-577.
-
Tsukamoto T, *Sudo Y. “Sensory rhodopsins” (2014) In: eLS. John Wiley & Sons, Ltd: Chichester. DOI: 10.1002/9780470015902.a0022838
-
須藤雄気, 入枝泰樹 他 “アナベナセンサリーロドプシンを利用したタンパク質発現法”
特願2010-181053.,特許番号:第5828422号(2015/10/30)
-
井上剛, 吉田渚, 大槻剛巳, 李順姫 “乳酸脱水素酵素阻害剤およびそれを含有する医薬品”
PCT/JP2014/051254. (2013) -
【須藤】
【井上】
【招待講演(国際学会・研究会)】
-
Sudo Y. “A rich diversity of microbial photoactive retinal proteins with a wide variety of biological functions” (2015) The 7th Asia and Oceania Conference for Photobiology (AOCP), Nov 18, Taipei, Taiwan.
-
-
Sudo Y. “Molecular-based rational design and engineering of microbial retinal proteins for optogenetics” (2014) The 16th International Conference on Retinal Proteins, Oct 9, Nagahamai, Japan.
Sudo Y. “Rational Design and Engineering of Photoactive Retinal Proteins” (2014) The 2nd Awaji International Workshop on “Electron Spin Science & Technology: Biological and Materials Science Oriented Applications (2nd AWEST 2014), June 17, Awaji, Japan.
Sudo Y. “Photobiophysical chemistry: What should we learn from retinal proteins?” (2014) iCeMS Symposium on Mesoscopic Chemical Biology: Integrated Chemical-Physical Systems Towards Cell Control, Feb 2, Kyoto, Japan.
-
Sudo Y. “Functional diversity of sensory rhodopsins from microbes” (2012) The 15th International Conference on Retinal Proteins, Sept 30, Ascona, Switzerland.
-
Sudo Y. et al., “Molecular and evolutionary aspects of microbial sensory rhodopsin” (2011) The 5th Asia and Oceania Conference for Photobiology (AOCP), Sept 31, Nara, Japan.
*2010年以前はこちら
【招待講演(国内学会・研究会・セミナー)】
須藤雄気 “Towards production of retinal protein-based optogenetic tools” (2016) 第54回 日本生物物理学会年会 シンポジウム, つくば, 11, 26.
須藤雄気 “Comparative study of the ion flux pathway in stator units of proton- and sodium-driven flagellar motors” (2016) 第54回 日本生物物理学会年会(つくば)『BPPB論文賞受賞講演』, つくば, 11, 25.


須藤雄気 “発色団に着目したロドプシンの機能変換による光操作ツールの開発” (2016) 第8回光操作研究会, 東京, 9, 30.
須藤雄気、塚本卓 “温泉微生物が持つ光受容レチナールタンパク質の機能・構造解析” (2016) 第19回・日本光生物学協会年会, 東京, 7, 28.
須藤雄気 “山あり谷ありの光受容ロドプシンタンパク質研究” (2016) 金沢大学バイオAFM先端研究センターセミナー, 金沢, 7, 14.
須藤雄気 “光がくすりになる!?” (2016) 第22回岡山大学薬学部公開講演会, 岡山, 6, 12.
須藤雄気 “光受容レチナールタンパク質の分子機能から考えるオプトジェネティクス研究の10年” (2016) バイオ単分子研究会, 福島, 3, 30.
須藤雄気 “微生物光受容レチナールタンパク質の多様性と可能性を探る” (2015) 2015年光化学討論会
光生物関係シンポジウム, 光・生物学:光を感じ、光で操る, 大阪, 9, 9.
須藤雄気 “光を薬へ!?:レチナールタンパク質を「知る」「変える」「役立てる」” (2015) 第55回 生物物理学会若手の会 夏の学校 , 琵琶湖, 8, 23.
須藤雄気 “光があれば何でもできる!?レチナールタンパク質の分子機能と共役した生命機能の光操作” (2015) 先端光科学若手研究会, 東京, 6, 14.

須藤雄気 “光受容レチナールタンパク質の構造・機能解析:光 + タンパク質 = 薬!?” (2015) 日本薬学会第135年会・シンポジウム 「受容体とトランスポーターの構造薬理学」, 神戸, 3, 27.
須藤雄気 “ビタミンAアルデヒドを発色団とする光受容タンパク質の多様性と可能性が拓く光創薬科学” (2015) 神戸薬科大学特別研究セミナー, 神戸, 2, 20.
-
須藤雄気 “レチナールタンパク質が拓くフォトクロミックバイオマテリアル” (2015) 第3回 日本バイオマテリアル学会中四国シンポジウム, 岡山, 1, 28.
須藤雄気 “高い安定性を示す新規レチナールタンパク質TRの機能・構造と光操作への展開” (2015) 新学術領域研究 『柔らかな分子系』 第8回ワークショップ, 瀬戸内, 1, 25.
須藤雄気 “光が薬になる時代を目指して” (2014) 第1回 岡山大学薬学部 4研究室合同リトリート, 瀬戸内, 11, 1.
須藤雄気 “レチナールタンパク質による光合成モドキが 世界を救う!?” (2014) 自然科学研究機構 分間連携ワークショップ, 蒲郡, 10, 24.
須藤雄気 “Converting a Light-driven Proton Pump into a Light-gated Ion Channel” (2014) The 52th Annual Meeting of the Biophysical Society of Japan, 札幌, 9, 26.
須藤雄気 “Photoactive Retinal Proteins as a Controller for Biological Functions” (2014) 岡山大学歯学部・セミナー, 岡山, 6, 11.
須藤雄気 “光生物物理化学:レチナールタンパク質の理解と利用” (2014) 岡山大学異分野融合コア・セミナー, 岡山, 5, 9.
須藤雄気 “微生物型レチナールタンパク質の非常識で未来を拓く” (2013) 分子科学研究所研究会「ロドプシン研究の故きを温ねて新しきを知る」, 岡崎, 11, 19.
-
須藤雄気 “光受容レチナールタンパク質の常識と非常識” (2013) 東京工業大学第1回生体分子専攻・若手コロキウム, 横浜, 8, 29.
-
須藤雄気 “微生物型レチナールタンパク質の理解と利用” (2013) 大阪市立大学セミナー, 大阪, 6, 4.
-
須藤雄気 “ロドプシンの、ロドプシンによる、ロドプシンのための蛋白質科学” (2013) 大阪大学蛋白研セミナー, 吹田, 4, 20.
-
須藤雄気 “光操作技術の基盤となるロドプシン分子の多様性と可能性” (2012) 第7回・NIBBバイオイメージングフォーラム, 基礎生物学研究所, 11, 26.
-
須藤雄気 “分子からのボトムアップ研究で拓く光細胞・個体操作” (2012) 「細胞を創る」研究会5.0, 東京工業大学, 11, 21.
-
須藤雄気 “微生物の光利用と光制御ツール開発” (2012) 「次世代の光の利用と物質材料・生命機能」研究会, 早稲田大学, 10, 20.
-
須藤雄気 “ロドプシンによる微生物の光利用と光制御ツール開発” (2012) 九州大学生体防御医学研究所セミナー, 福岡, 8, 31.
-
須藤雄気 “I love rhodopsins: 微生物の光利用と光制御ツール開発” (2012) 首都大学東京化学科セミナー, 八王子, 8, 22.
-
須藤雄気 “「Simple is the first? 」: 微生物由来レチナール蛋白質の分子進化と多様性” (2012) 第14回日本進化学会年会シンポジウム, 八王子, 8, 21.
-
須藤雄気 “微生物型光受容タンパク質の解析と光制御ツール開発” (2012) 第17回日本光生物学協会年会, 大阪, 8, 18.
-
須藤雄気 “センサー型ロドプシンの分子科学” (2012) 北海道大学理学部セミナー, 札幌, 7, 3.
-
須藤雄気 “光生物物理学-基礎研究のススメ。渇望される薬学部生” (2012) 北海道大学薬学部 第19回「先輩と語る」講演会, 札幌, 7, 2.
-
須藤雄気 “Cell and micro-organism manipulations with photo-functional and photo-controllable proteins” (2012) 日本化学会第92春期年会・JST さきがけ研究領域合同国際シンポジウム「持続する社会を先導する光科学:環境・エネルギー・機能材料」, 横浜, 3, 26.
-
須藤雄気 “色付きタンパク質の生物学的・化学的・物理学的研究の“面白さ”と”奥深さ” (2012) 第1回超異分野学会, 東京, 3, 17.
-
須藤雄気 “微生物型ロドプシンタンパク質の利用を考える” (2012) NINS「若手研究者による分野間連携研究プロジェクト」冬の会議, 箱根, 1, 13.
-
須藤雄気 “センサリーロドプシンとの出会いと今後の野望” (2011) 生物物理化学研究会シンポジウム「光といのち」, 名古屋, 12, 25.
-
須藤雄気 “微生物型ロドプシンの基礎的研究とそこから見える新たな地平” (2011) 横浜国大グループ研究セミナー「細胞膜中機能性生体分子の構造生物学的研究」, 横浜, 12, 5.
-
須藤雄気(シンポジウム世話人) “分子科学研究にとっての光受容タンパク質” (2011) 特定領域研究「高次系分子科学」 第12回ミニ公開シンポジウム, 蒲郡, 10, 26.
-
須藤雄気 他(シンポジウムオーガナイザー) “What should we learn from sensory rhodopsins? : Signal transfer mechanism and its application for protein expression” (2011) The 49th Annual Meeting of the Biophysical Society of Japan「Photobiophysics promoted by young scientists」, 姫路, 9, 17.
-
須藤雄気 他 “微生物型ロドプシンタンパク質における特異な光反応” (2011) 生理学研究所研究会「作動中の膜機能分子の姿を捉える-静止画から動画へ-」, 岡崎, 9, 9.
-
須藤雄気 “7回膜貫通型色素結合タンパク質(ロドプシン)の調製法” (2011) 第11回・日本蛋白質科学会年会 蛋白質科学会アーカイブワークショップ, 大阪, 6, 9.
-
須藤雄気 “ロドプシンに魅せられて-微生物の光情報伝達と光制御ツール開発-” (2011) 筑波大学・物質工学セミナー, 筑波, 4, 19.
-
須藤雄気 他 “機能性・制御性膜タンパク質(微生物型ロドプシン)による新しい解析ツールの創成に向けて” (2011) 日本薬学会第131年会シンポジウム「生体反応・細胞挙動のセンシング-光を使って何ができるのか?-」, 静岡, 3, 29. *震災により要旨にて発表
*2010年以前はこちら
【須藤】
・第54回 日本生物物理学会年会/シンポジウム「Perspective in biophysical studies on protein molecules applicable for optogenetics」(オーガナイザー:古谷祐詞、須藤雄気), つくば, 11/26
(2016).
・『戦略的創造研究推進事業「CREST」第1回領域研究会を主催』, 湯原, 11/02-03 (2016)


・『光科学おかやま研究会(第4回:増原さきがけ1期生の会)を主催』, 岡山, 9/11 (2016).
-
・第1回 岡山大学薬学部 4研究室合同リトリート, 瀬戸内市 11/1-2(2014).


・第52回 日本生物物理学会年会/シンポジウム「ポンプとチャネルはどちらが偉いのか」(オーガナイザー:飯野亮太、須藤雄気), 札幌, 9/26 (2014).
・大阪大学蛋白質研究所セミナー「光の、光による、光のための蛋白質科学」(オーガナイザー:永井健治、石北央、須藤雄気), 吹田, 4/20-21 (2013).
・新学術領域研究 『柔らかな分子系』 第8回ワークショップ, 瀬戸内, 1/24-25 (2015).


・特定領域研究「高次系分子科学」 第12回ミニ公開シンポジウム, 蒲郡, 10/26-27 (2011).
-
・The 49th Annual Meeting of the Biophysical Society of Japan「Photobiophysics promoted by young scientists」(オーガナイザー:増田真二、須藤雄気), 姫路, 9/17 (2011).
・分子研研究会「拡がるロドプシンの仲間から”何がわかるか“”何をもたらすか“」, 岡崎, 3/23-24 (2010).
-
・第45回・日本生物物理学会年会/シンポジウム「膜蛋白質を介したエネルギー・情報伝達機構を若手研究者が深く考える」(オーガナイザー:村田武士、須藤雄気), 横浜, 12/23 (2007).
-
・平成21年度 光科学技術研究振興財団 研究者表彰
・平成28年度 文部科学大臣表彰 若手科学者賞
【須藤】
■代表
【須藤】
- ・挑戦的研究(萌芽)(R2~R4)
総額 5,000千円 (*分担:山田勇磨(北海道大学))
光誘起崩壊リポソーム(LiDL)の開発による新奇薬物送達手法の確立
- ・新学術領域研究「発動分子科学」(公募)(H31/R1~R2)
総額 4,500千円
ロドプシンを起動分子とした「化学・力学・光」エネルギー発動機構の理解と利用
- ・基盤研究(B)(H30~R2)
総額 13,400千円
ロドプシンの多様性の探求と可能性の追求
- ・新学術領域研究「新光合成」(公募)(H29~R2)
総額 10,800千円
ロドプシンによる葉緑体プロトン勾配制御システムの確立と植物応答解析への展開
- ・受託研究(上原記念生命科学財団)(H28)
総額 4,000千円
レチナールタンパク質によるボトムアップ型生体光操作
- ・基盤研究(B)(H27~H29)
総額 12,600千円
レチナールタンパク質を「知る・変える・役立てる」
- ・新学術領域研究「人工光合成」(公募)(H27~H28)
総額 3,000千円
カロテノイドを光捕集系とするレチナールタンパク質の創出と展開
- ・受託研究(ノバルティス科学振興財団)(H27)
総額 1,000千円
拡張型レチナールタンパク質による光生命機能操作
- ・受託研究(光科学技術研究振興財団)(H26~H27)
総額 1,200千円
微生物における光情報伝達の時空間的調和機構の解析
- ・受託研究(イオン工学振興財団)(H26)
総額 800千円
様々なイオンを輸送基質とするレチナールタンパク質の探索・解析・創成
- ・平成26年度大学機能強化戦略経費(岡山大学学内公募)(H26)
総額 7,000千円
創薬標的膜タンパク質の移ろいを“み(見・診・覧)る"
- ・若手研究(A)(日本学術振興会)(H23~H26)
総額 21,000千円
光情報伝達のサブÅ・ピコ秒分解能での全経路詳細解析(23687019)
- ・受託研究(株式会社リバネス研究費)(H24)
総額 500千円
新規光機能性分子の発掘とその利用
- ・挑戦的萌芽研究(日本学術振興会)(H23~H25)
総額 3,500千円
色を知り、色を作る:ロドプシンタンパク質群の挑戦(23657100)
- ・新学術領域研究 研究領域提案型「過渡的複合体」(文部科学省)(H22~H25)
総額 17,400千円
全反射型赤外分光法による過渡的複合体の解析(22121508)
振動分光法による過渡的膜タンパク質複合体の解析(24121712)
- ・若手研究(B)(日本学術振興会)(H21~H22)
総額 3,600千円
べん毛モーター固定子複合体の相互作用・イオン透過・構造変化の解析(21770166)
- ・戦略的創造研究推進事業・「さきがけ」(科学技術振興機構(JST))(H20~H23)
総額 45,000千円
光機能性・制御性蛋白質による細胞・個体操作(08062256)
- ・特定領域研究 公募研究「高次系分子科学」(文部科学省)(H20~H23)
総額 7,600千円
膜蛋白質の機能変換から観る機能-構造変化の連関性と分子論的理解(20050012)
センサー型ロドプシンの分子科学:機能と構造変化の連関性(22018010)
- ・若手(スタートアップ) (日本学術振興会)(H19)
総額 1,370千円
分子生理学的解析から探る膜蛋白質複合体の機能発現機構(19870010)
■分担
【須藤】
- ・「革新的技術による脳機能ネットワークの全容解明プロジェクト 」(AMED)(H29~R2)
総額 32,000千円
神経活動計測・操作を実現する革新的な全光型電気生理学的手法の開発
(代表:坂本雅行ー東京大学)
- ・戦略的創造研究推進事業・「CREST」(科学技術振興機構(JST))(H28~R3)
総額 38,250千円
ファイバーレス光遺伝学による高次脳機能を支える本能機能の解析(代表:山中章弘ー名古屋大学)
- ・新学術領域研究「柔らかな分子系」(文部科学省)(H26~H27)
総額 5,000千円
光応答性タンパク質の機能変換が明らかにする柔らかな構造機能相関
(代表:神取秀樹ー名古屋工業大学)
- ・戦略的創造研究推進事業・「CREST」(科学技術振興機構(JST))(H25~H26)
総額 3,850千円
光神経電子集積回路開発と機能解析・応用(代表:宇理須恒雄ー名古屋大学)